Diferencia entre revisiones de «Ciclodextrina»
m Revertidos los cambios de 189.177.240.144 (disc.) a la última edición de AVBOT |
|||
| Línea 18: | Línea 18: | ||
γ-Ciclodextrina: n = 8 moléculas de glucosa (Diámetro/Altura de la cavidad: 7,5..8,3/7,9A). |
γ-Ciclodextrina: n = 8 moléculas de glucosa (Diámetro/Altura de la cavidad: 7,5..8,3/7,9A). |
||
δ-Ciclodextrina: n = 9 moléculas de glucosa. |
δ-Ciclodextrina: n = 9 moléculas de glucosa. |
||
<nowiki>--~~~~Introduce aquí texto sin formato |
|||
---- |
|||
</nowiki> |
|||
En la bibliografía se describen ciclodextrinas hasta con 17 unidades de [[glucosa]] pero no tienen importancia económica ya que los homólogos superiores son difíciles de separar y sus propiedades como huésped de moléculas orgánicas son malas. |
En la bibliografía se describen ciclodextrinas hasta con 17 unidades de [[glucosa]] pero no tienen importancia económica ya que los homólogos superiores son difíciles de separar y sus propiedades como huésped de moléculas orgánicas son malas. |
||
Revisión del 18:45 11 mar 2010
Las ciclodextrinas son oligosacáridos cíclicos y se forman en algunos procesos de degradación del almidón. A veces también son llamadas cicloamilosas.
Historia
Fueron aisladas por primera vez en 1891 por Villiers y Schardinger los identificó en 1903 como oligosacáridos. Durante décadas eran curiosidades de laboratorio sin gran interés aunque entre 1911 y 1935 el químico alemán Pringsheim demostró que podían formar complejos de inclusión. Estos trabajos fueron retomados por Cramer en los años '50.
En los últimos años se ha notado un número creciente de artículos científicos que se ocupan de ellas y se han patentado diversas aplicaciones ya que presentan un exterior hidrofílico y una cavidad interior hidrofóbica donde pueden acoger moléculas orgánicas no polares.
Nomenclatura
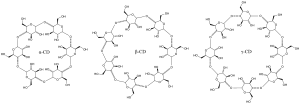
Según el número de unidades de glucosa que forman la ciclodextrina esta se nombra con una letra griega diferente:
α-Ciclodextrina: n = 6 moléculas de glucosa (Diámetro/Altura de la cavidad: 4,7..5,3/7,9A).
β-Ciclodextrina: n = 7 moléculas de glucosa (Diámetro/Altura de la cavidad: 6,0..6,5/7,9A).
γ-Ciclodextrina: n = 8 moléculas de glucosa (Diámetro/Altura de la cavidad: 7,5..8,3/7,9A).
δ-Ciclodextrina: n = 9 moléculas de glucosa.
En la bibliografía se describen ciclodextrinas hasta con 17 unidades de glucosa pero no tienen importancia económica ya que los homólogos superiores son difíciles de separar y sus propiedades como huésped de moléculas orgánicas son malas.
El enlace entre las subunidades pasa de forma α-glicosítica entre los carbonos 1 y 4 de los ciclos de la glucosa.
Síntesis
Las ciclodextrinas se obtienen en la degradación enzimática del almidón. El almidón más utilizado como materia prima es el del maíz.
Las enzimas utilizadas se llaman ciclodextrin-glicosil-transferasas (CGT-asas). Están presentes en diversos microorganismos. El primero en ser explotado era el Bacillus macerans. Hoy en día las enzimas se obtienen con procesos de tecnología genética a partir de organismos genéticamente modificados.
El principal propósito en la síntesis de las ciclodextrinas es obtener un producto uniforme que contenga el máximo porcentaje del número de moléculas de glucosa por unidad deseado ya que las aplicaciones dependen mucho del tamaño de la cavidad.
Aplicaciones
Las ciclodextrinas se utilizan en la industria farmacéutica para aumentar la solubilidad de algunos fármacos en agua. Las moléculas del principio activo se incluyen en la cavidad y pueden ser transportadas por la ciclodextrina hasta el lugar de su actuación. Además las protegen del oxígeno y de la irradiación UV y las liberan uniformemente sobre un tiempo prolongado.
En los productos del uso diario las ciclodextrinas se encuentran en la formulación de algunos ambientadores donde atrapan supuestamente algunas de las moléculas que provocan los malos olores.
En química analítica se utilizan ciclodextrinas y derivados para preparar columnas capilares en separaciones cromatográficas de enantiómeros debido a sus propiedades quirales.
Analítica
Las ciclodextrinas pertenecen al grupo de carbohidratos no reductores. Así que no reaccionan con el reactivo de Fehling. Sin embargo pueden ser identificado por su aducto con 9[10H]-antracenona.
Derivados
Para cambiar las propiedades físicas y químicas de las ciclodextrinas se han desarrollado diversos derivados. Unos de los más utilizados son los derivados parcialmente metilados que tienen una solubilidad en agua hasta 150 veces superior a la del producto de partida. Además se están sintetizando carbohidratos cíclicos derivados de otros carbohidratos como la fructosa, maltosa etc.
Reacciones generales
Las ciclodextrinas son estables en disoluciones neutras y básicas pero se degradan lentamente con un pH ácido.
En sólido empiezan a descomponerse por encima de los 200 °C.
Toxicología
No se conocen efectos tóxicos de las ciclodextrinas. En el caso de la β-ciclodextrina se ha podido demostrar su inocuoidad. Sólo en caso de inyección intravenosa forma complejos con el colesterol que precipitan de la sangre y pueden colapsar el sistema cardiovascular.
En algunos países las ciclodextrinas están admitidas como aditivo en la fabricación de los alimentos aunque la OMS recomienda no ingerir más de 6 mg/kg diario de estos compuestos.
