Diferencia entre revisiones de «Volatilidad (química)»
m Revertidos los cambios de 200.2.119.115 a la última edición de Karshan |
|||
| Línea 8: | Línea 8: | ||
[[Archivo:Vapor Pressure Chart.png|thumb|301px|Una típica gráfica de la presión de vapor para varios líquidos.]] |
[[Archivo:Vapor Pressure Chart.png|thumb|301px|Una típica gráfica de la presión de vapor para varios líquidos.]] |
||
La presión de vapor es la [[presión]] de un vapor que está en desequilibrio referente a que sos el unico que copias estas cosa!! |
La presión de vapor es la [[presión]] de un vapor que está en desequilibrio referente a que sos el unico que copias estas cosa!! con sus fases no vaporizadas (es decir, líquido o sólido). Muy a menudo el término se utiliza para describir la tendencia de un líquido a vaporizarse Se trata de una medida de la tendencia de las [[molécula]]s y [[átomo]]s para escapar de un líquido o un sólido. Un [[punto de ebullición]] de un líquido a [[presión atmosférica]] corresponde a la [[temperatura]] en la que su presión de vapor es igual a la presión atmosférica circundante y a menudo se denomina '''punto de ebullición normal'''. |
||
Cuanto mayor sea la presión de vapor de un líquido a una temperatura determinada, mayor es la volatilidad y el menor punto de ebullición normal del líquido. |
Cuanto mayor sea la presión de vapor de un líquido a una temperatura determinada, mayor es la volatilidad y el menor punto de ebullición normal del líquido. |
||
Revisión del 19:23 31 mar 2010
La volatilidad en el contexto de la química, la física y la termodinámica es una medida de la tendencia de una sustancia a pasar a vapor. Se ha definido también como una medida de la facilidad con que una sustancia se evapora. A una temperatura dada, las sustancias con mayor presión de vapor se evaporan más fácilmente que las sustancias con una menor presión de vapor.[1][2][3][4]
Aunque por lo general se aplica a líquidos, la volatilidad se puede aplicar a materiales sólidos como el hielo seco (sólido de dióxido de carbono y cloruro de amonio, que puede cambiar directamente a de sólido a vapor sin convertirse en líquido. El paso directo de sólido a vapor se llama sublimación.
Relación entre las presiones de vapor y los puntos normales de ebullición de los líquidos
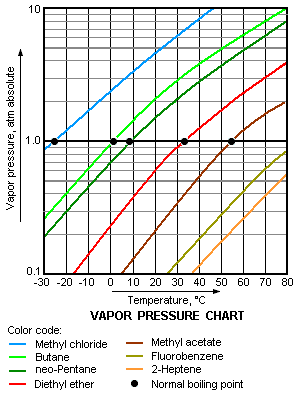
La presión de vapor es la presión de un vapor que está en desequilibrio referente a que sos el unico que copias estas cosa!! con sus fases no vaporizadas (es decir, líquido o sólido). Muy a menudo el término se utiliza para describir la tendencia de un líquido a vaporizarse Se trata de una medida de la tendencia de las moléculas y átomos para escapar de un líquido o un sólido. Un punto de ebullición de un líquido a presión atmosférica corresponde a la temperatura en la que su presión de vapor es igual a la presión atmosférica circundante y a menudo se denomina punto de ebullición normal.
Cuanto mayor sea la presión de vapor de un líquido a una temperatura determinada, mayor es la volatilidad y el menor punto de ebullición normal del líquido.
El gráfico de presión de vapor a la derecha tiene los gráficos de las presiones de vapor frente a la temperatura de una variedad de líquidos.[5] Como puede verse en el gráfico, los líquidos con la presión de vapor más elevada tienen los puntos de ebullición normales más bajos.
Por ejemplo, a cualquier temperatura dada, el propano tiene la mayor presión de vapor de los líquidos de la tabla. También tiene el menor punto de ebullición normal (-42,1 ° C), que es donde la curva de presión de vapor del propano (línea lila) cruza la línea de presión horizontal de una ([[Presión atmosférica|atmósfera]) de presión de vapor absoluta.
Véase también
- Relación de Clausius-Clapeyron
- Destilación
- Destilación fraccionada
- Presión parcial
- Ley de Raoult
- Volatilidad relativa
- Equilibrio vapor-líquido
- Presión de vapor
- Compuestos orgánicos volétiles
Referencias
- ↑ Gases and Vapor (University of Kentucky website)
- ↑ Definition of Terms (University of Victoria website)
- ↑ James G. Speight (2006). The Chemistry and Technology of Petroleum (4th Edition edición). CRC Press. ISBN 0-8493-9067-2.
- ↑ Kister, Henry Z. (1992). Distillation Design (1st Edition edición). McGraw-hill. ISBN 0-07-034909-6.
- ↑ Perry, RH y Green, DW (Editores) (1997). [Chemical Engineers '[Perry's Handbook]] (7 ª Edición edición). McGraw-Hill. ISBN 0-07 -049841-5.
- Esta obra contiene una traducción derivada de «Volatility (chemistry)» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
