Bromo
| Selenio ← Bromo → Kriptón | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Tabla completa • Tabla ampliada | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Información general | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nombre, símbolo, número | Bromo, Br, 35 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Serie química | Halógenos | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Grupo, período, bloque | 17, 4, p | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masa atómica | 79,909 u | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuración electrónica | [Ar] 3d10 4s2 4p5 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electrones por nivel | 2, 8, 18, 7 (imagen) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Apariencia |
Gas o líquido: marrón rojizo Sólido: metálico lustroso | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades atómicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio medio | 115 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Electronegatividad | 2,96 (escala de Pauling) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio atómico (calc) | 94 pm (radio de Bohr) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio covalente | 114 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Radio de van der Waals | 185 pm | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado(s) de oxidación | -1', +1, +3, +5, +7, | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Óxido | Ácido fuerte | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1.ª energía de ionización | 1139,9 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 2.ª energía de ionización | 2103 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3.ª energía de ionización | 3470 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 4.ª energía de ionización | 4560 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5.ª energía de ionización | 5760 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 6.ª energía de ionización | 8550 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 7.ª energía de ionización | 9940 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 8.ª energía de ionización | 18600 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Líneas espectrales |
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propiedades físicas | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estado ordinario | Líquido muy móvil y volátil | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Densidad | (26,85 °C) 3119 kg/m3 | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de fusión | 265,8 K (−7 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Punto de ebullición | 332 K (59 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de vaporización | 15,438 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Entalpía de fusión | 5,286 kJ/mol | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Presión de vapor | 5800 Pa a 6,85 °C | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Varios | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Estructura cristalina | Ortorrómbica | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Calor específico | 480 J/(K·kg) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductividad térmica | 0,122 W/(K·m) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Velocidad del sonido | 206 m/s a 293,15 K (20 °C) | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isótopos más estables | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Artículo principal: Isótopos del bromo | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Valores en el SI y condiciones normales de presión y temperatura, salvo que se indique lo contrario. | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
El bromo es un elemento químico de número atómico 35 situado en el grupo de los halógenos (grupo VII A) de la tabla periódica de los elementos. Su símbolo es Br.[1][2]
El bromo a temperatura ambiente es un líquido rojo, volátil y denso. Su reactividad es intermedia entre el cloro y el yodo. En estado líquido es peligroso para el tejido humano y sus vapores, cuya emanación se puede apreciar claramente a temperatura ambiente, irritan nariz, garganta y ojos, incluso en lugares ventilados.
El bromo elemental es muy reactivo y, por tanto, no se encuentra libre en la naturaleza, sino en sales minerales cristalinas incoloras de haluro, análogas a la sal de mesa. Aunque es bastante raro en la corteza terrestre, la alta solubilidad del ion bromuro (Br-) ha provocado su acumulación en los océanos. Comercialmente, el elemento se extrae fácilmente de los estanques de evaporación de salmuera, sobre todo en Estados Unidos, Israel y China. La masa de bromo en los océanos es aproximadamente una trescientosava parte de la del cloro.
En condiciones normalizadas de presión y temperatura es un líquido; el único otro elemento que es líquido en estas condiciones es el mercurio. A altas temperaturas, los compuestos de organobromo se disocian fácilmente para dar lugar a átomos de bromo libres, un proceso que detiene las reacciones químicas en cadena de los radicales libres. Este efecto hace que los compuestos de organobromo sean útiles como retardantes del fuego, y más de la mitad del bromo que se produce cada año en el mundo se destina a este fin. La misma propiedad hace que la luz solar ultravioleta disocie los compuestos organobromados volátiles en la atmósfera para dar lugar a átomos de bromo libres, lo que provoca el agotamiento del ozono. Por ello, muchos compuestos organobromados -como el pesticida bromuro de metilo- han dejado de utilizarse. Los compuestos de bromo se siguen utilizando en los fluidos de perforación de pozos, en las películas fotográficas y como intermedio en la fabricación de productos químicos orgánicos.
Las sales de bromuro en grandes cantidades son tóxicas por la acción de los iones de bromuro solubles, causando bromismo. Sin embargo, recientemente se ha dilucidado un claro papel biológico para el ion bromuro y el ácido hipobromoso, y ahora parece que el bromo es un oligoelemento esencial en los seres humanos. El papel de los compuestos biológicos de organobromo en la vida marina, como las algas, se conoce desde hace mucho más tiempo. Como producto farmacéutico, el ion bromuro simple (Br-) tiene efectos inhibidores sobre el sistema nervioso central, y las sales de bromuro fueron en su día un importante sedante médico, antes de ser sustituidas por fármacos de acción más corta. Conservan usos especializados como antiepilépticos.
Historia[editar]


El bromo (del griego bromos, que significa "hedor" o pestilencia) fue descubierto en 1826 por Antoine-Jérôme Balard[3] [4] e independientemente por Carl Jacob Löwig[5] en 1825 y 1826, respectivamente.[6] pero no se produjo en cantidades importantes hasta 1860.
Löwig aisló el bromo de un manantial de agua mineral de su ciudad natal Bad Kreuznach en 1825. Löwig utilizó una solución de la sal mineral saturada de cloro y extrajo el bromo con éter dietílico. Tras la evaporación del éter, quedó un líquido marrón. Con este líquido como muestra de su trabajo solicitó un puesto en el laboratorio de Leopold Gmelin en Heidelberg. La publicación de los resultados se retrasó y Balard publicó primero sus resultados.[7]
Balard encontró sustancias químicas de bromo en las cenizas de algas de las marismas de Montpellier. Las algas se utilizaban para producir yodo, pero también contenían bromo. Balard destiló el bromo a partir de una solución de cenizas de algas saturada de cloro. Las propiedades de la sustancia resultante eran intermedias entre las del cloro y las del yodo, por lo que intentó demostrar que la sustancia era monocloruro de yodo (ICl), pero tras fracasar en su intento estuvo seguro de haber encontrado un nuevo elemento y lo denominó mururo, derivado de la palabra latina muria. ("salmuera").[4]
Después de que los químicos franceses Louis Nicolas Vauquelin, Louis Jacques Thénard y Joseph-Louis Gay-Lussac aprobaran los experimentos del joven farmacéutico Balard, los resultados fueron presentados en una conferencia de la Académie des Sciences y publicados en Annales de Chimie et Physique.[3] En su publicación, Balard declaró que había cambiado el nombre de muride por el de brôme a propuesta de M. Anglada. El nombre brôme (bromo) deriva de la griega βρῶμος (brômos, "hedor").[3][8] Otras fuentes afirman que el químico y físico francés Joseph-Louis Gay-Lussac sugirió el nombre de brôme por el olor característico de los vapores.[9][10] El bromo no se produjo en grandes cantidades hasta 1858, cuando el descubrimiento de depósitos de sal en Stassfurt permitió su producción como subproducto de la potasa.[11]
Aparte de algunas aplicaciones médicas menores, el primer uso comercial fue el daguerrotipo. En 1840, se descubrió que el bromo tenía algunas ventajas sobre el vapor de yodo utilizado anteriormente para crear la capa de haluro de plata sensible a la luz en la daguerrotipia.[12]
Abundancia y obtención[editar]
La mayor parte del bromo se encuentra en el mar en forma de bromuro, Br-. En el mar presenta una concentración de unos 65 µg/g.
El bromo molecular, Br2 se obtiene a partir de las salmueras, mediante la oxidación del bromuro con cloro, una vez obtenido este:
- 2Br - + Cl2 → Br2 + 2Cl-
Es necesario emplear un proceso de destilación para separarlo del Cl2.
Aproximadamente se producen en el mundo 500 millones de kilogramos de bromo por año (2001). Estados Unidos e Israel son los principales productores. Las aguas del mar Muerto y las minas de Stassfurt son ricas en bromuro de potasio.
Compuestos[editar]
Puede presentar distintos estados de oxidación. Los más comunes son -1 (lo más común), +1 (con cloro) +3 (con flúor) y +5 (con oxígeno).
- El estado de oxidación +1 es poco estable, pero muy oxidante desde el punto de vista cinético, en disolución acuosa y desproporciona a los estados de oxidación -1 y +5. Por ejemplo, el ion hipobromito, BrO- (sólo estable a bajas temperaturas 0 °C).
- El estado de oxidación +3 es poco estable en disolución acuosa y desproporciona a los estados de oxidación +1 y +5. Por ejemplo, el ion bromito, BrO2-, o el ácido bromoso, HBrO2 (muy inestable).
- El estado de oxidación +5 es termodinámicamente estable frente a la desproporción en disolución acuosa. Por ejemplo, el ion bromato, BrO3-. El bromato es un oxidante fuerte (como el permanganato) más oxidante que el clorato y cinéticamente más reactivo. Es además un carcinógeno (sospechas muy fuertes).
- El ion perbromato, BrO4-, con un estado de oxidación +7, se reduce con relativa facilidad y se prepara con dificultad: empleando flúor elemental o por métodos electrolíticos, es un oxidante muy fuerte 1,8 aunque algo lento desde el punto cinético.
El BrO3F (fluoruro de perbromilo) es un agente nuevo mucho más inestable que el análogo clorado y tan reactivo que destruye hasta el teflón. Es también un ácido de Lewis al contrario de su homólogo clorado fluoruro de perclorilo, formando un complejo BrO3F2(-1) análogo al XeO3F2. Cuando reacciona con ácidos de Lewis el bromo se reduce a +5 desprendiendo oxígeno, el análogo clorado no reacciona con pentafluoruro de antimonio SbF5.
- El bromo también forma compuestos con otros halógenos (interhalógenos). Por ejemplo, BrF5, BrF3, IBr, etc.
El BrF5, es un líquido que reacciona explosivamente con casi todas las sustancias muy similar en reactividad al ClF3 capaz de hacer arder a las sustancias utilizadas como extintores, el agua, vidrio, óxidos, haluros y una amplia variedad de sustancias inorgánicas reaccionan, las sustancias orgánicas reaccionan explosivamente.
- Hay muchos compuestos en los que el bromo presenta estado de oxidación -1, llamándose a estos bromuros.
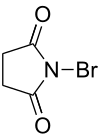
Se pueden obtener fácilmente compuestos orgánicos bromados, por ejemplo, mediante bromación radicalaria con bromo molecular y en presencia de luz o empleando N-bromosuccinimida, o bien por reacciones de adición o de sustitución. El compuesto orgánico bromuro de metilo, CH3Br, se emplea como plaguicida, pero afecta a la capa de ozono. Se ha determinado que los átomos de bromo son más eficaces que los de cloro en los mecanismos de destrucción de la capa de ozono, sin embargo los átomos de bromo están en menor cantidad.
El bromuro de hidrógeno, HBr, se obtiene por reacción directa de bromo con hidrógeno molecular o como subproducto de procesos de bromación de compuestos orgánicos.A 400º ataca al vidrio.Es muy ácido. A partir de este, se pueden obtener distintos bromuros, por ejemplo:
- HBr + NaOH → NaBr + H2O
Es mucho más inestable que su análogo clorado y es reductor.
El ácido nítrico oxida a los bromuros en presencia de nitritos enérgicamente.
El bromo en disolución acuosa puede desproporcionar:
- Br2 + OH- → Br- + BrOH
Pero la reacción no transcurre en medio ácido.
También se puede obtener por oxidación el ion Br2+.
Bromuro de hidrógeno[editar]
El compuesto más simple de bromo es el bromuro de hidrógeno, HBr. Se utiliza principalmente en la producción de bromuros inorgánicos y bromuros de alquilo, y como catalizador para muchas reacciones en química orgánica. Industrialmente, se produce principalmente por la reacción de gas hidrógeno con gas bromo a 200-400 °C con un catalizador de platino. Sin embargo, la reducción de bromo con fósforo rojo es una forma más práctica de producir bromuro de hidrógeno en el laboratorio:[13]
- 2 P + 6 H2O + 3 Br2 → 6 HBr + 2 H3PO3
- H3PO3 + H2O + Br2 → 2 HBr + H3PO4
A temperatura ambiente, el bromuro de hidrógeno es un gas incoloro, como todos los halogenuros de hidrógeno excepto el fluoruro de hidrógeno, ya que el hidrógeno no puede formar enlaces de hidrógeno fuertes con el átomo de bromo, que es grande y poco electronegativo; sin embargo, en el bromuro de hidrógeno cristalino sólido hay enlaces de hidrógeno débiles a bajas temperaturas, similares a los de la estructura del fluoruro de hidrógeno, antes de que el desorden comience a prevalecer a medida que se eleva la temperatura.[13] El bromuro de hidrógeno acuoso se conoce como ácido bromhídrico, que es un ácido fuerte (P < 9) porque los enlaces de hidrógeno con el bromo son demasiado débiles para inhibir la disociación. El sistema HBr/H2O también incluye muchos hidratos HBr-nH2O para n = 1, 2, 3, 4 y 6, que son esencialmente sales de aniones de bromo e hidronio. catión. El ácido bromhídrico forma un azeótropo con un punto de ebullición de 124,3 °C a 47,63 g de HBr por 100 g de solución; por tanto, el ácido bromhídrico no puede concentrarse más allá de este punto por destilación.[14]
Otros bromuros binarios[editar]
Casi todos los elementos de la tabla periódica forman bromuros binarios. Las excepciones son decididamente minoritarias y se derivan en cada caso de una de tres causas: extrema inercia y renuencia a participar en reacciones químicas (los gases nobles, con la excepción del xenón en el muy inestable XeBr 2 ); inestabilidad nuclear extrema que dificulta la investigación química antes de la descomposición y la transmutación (muchos de los elementos más pesados más allá del bismuto ); y que tiene una electronegatividad superior a la del bromo ( oxígeno, nitrógeno, flúor y cloro).), de modo que los compuestos binarios resultantes no son formalmente bromuros sino óxidos, nitruros, fluoruros o cloruros de bromo. Sin embargo, el tribromuro de nitrógeno se denomina bromuro, ya que es análogo a los otros trihaluros de nitrógeno.[15]
Halogenuros de bromo[editar]
Los halógenos forman muchos compuestos binarios, interhalógenos diamagnéticos con estequiometrías XY, XY3, XY5, y XY7(donde X es más pesado que Y), y el bromo no es una excepción. El bromo forma un monofluoruro y un monocloruro, así como un trifluoruro y un pentafluoruro. También se caracterizan algunos derivados catiónicos y aniónicos, como BrF−
2, BrCl−
2, BrF+
2, y BrF+
6. Además de éstos, también se conocen algunos pseudohaluros, como el bromuro de cianógeno (BrCN), el tiocianato de bromo (BrSCN), y la azida de bromo (BrN3).[16]
Compuestos de polibromo[editar]
Aunque el dibromo es un agente oxidante fuerte con una energía de primera ionización alta, los oxidantes muy fuertes como el fluoruro de peroxidisulfurilo pueden oxidarlo para formar el catión+2 Br rojo cereza.
Óxidos de bromo y oxoácidos[editar]
Los óxidos de bromo no están tan bien caracterizados como los óxidos de cloro o los óxidos de yodo, ya que todos son bastante inestables: alguna vez se pensó que no podían existir en absoluto. El monóxido de dibromo es un sólido de color marrón oscuro que, si bien es razonablemente estable a -60 °C, se descompone en su punto de fusión de -17,5 °C; es útil en reacciones de bromación[17] y puede obtenerse a partir de la descomposición a baja temperatura del dióxido de bromo en el vacío. Oxida el yodo a pentóxido de yodo y el benceno a 1,4-benzoquinona ; en soluciones alcalinas, da el anión hipobromito.[18]
Papel biológico[editar]
El bromo se encuentra en niveles de trazas en humanos. Es considerado un elemento químico esencial, aunque no se conocen exactamente las funciones que realiza. Algunos de sus compuestos se han empleado en el tratamiento contra la epilepsia y como sedantes.
Isótopos[editar]
En la naturaleza se encuentran dos isótopos: 79Br y 81Br, los dos con una abundancia de cerca del 50%.
Aplicaciones[editar]
Las aplicaciones químicas e industriales del bromo son numerosas y variadas, destacando los compuestos organobromados, los cuales son preparados a partir de bromo diatómico o bien de bromuro de hidrógeno (ácido bromhídrico en disolución acuosa).
La prueba del bromo consiste en el uso de agua de bromo con el objetivo de detectar la presencia de compuestos orgánicos insaturados.
Los bromuros actúan médicamente como sedantes y el bromuro de plata se utiliza como un elemento fundamental en las placas fotográficas.
Precauciones[editar]
El bromo elemental es altamente tóxico y a partir de pequeñas trazas (10 ppm), tanto por vía cutánea como respiratoria, puede causar problemas inmediatos de salud y en dosis mayores la muerte. Es muy irritante tanto para los ojos como para la garganta; en contacto con la piel produce quemaduras dolorosas. Un manejo inapropiado supone un serio riesgo para la salud, requiriendo máximas precauciones para su gestión segura.
Referencias[editar]
- ↑ Garritz, Andoni (1998). Química. Pearson Educación. p. 856. ISBN 978-9-68444-318-1.
- ↑ Parry, Robert W. (1973). Química: fundamentos experimentales. Reverte. p. 703. ISBN 978-8-42917-466-3.
- ↑ a b c Balard, A. J. (1826). «Mémoire sur une substance particulière contenue dans l'eau de la mer» [Memoir on a peculiar substance contained in sea water]. Annales de Chimie et de Physique. 2nd series (en francés) 32: 337-381.
- ↑ a b Balard, Antoine (1826). «Memoir on a peculiar Substance contained in Sea Water». Annals of Philosophy 28: 381-387 and 411-426.
- ↑ Löwig, Carl Jacob (1829). Das Brom und seine chemischen Verhältnisse [Bromine and its chemical relationships] (en alemán). Heidelberg: Carl Winter.
- ↑ Weeks, Mary Elvira (1932). «El descubrimiento de los elementos: XVII. La familia de los halógenos». Journal of Chemical Education 9 (11): 1915. doi:10.1021/ed009p1915.
- ↑ Landolt, Hans Heinrich (1890). «Nekrolog: Carl Löwig». Berichte der deutschen chemischen Gesellschaft 23 (3): 905-909. doi:10.1002/cber.18900230395.
- ↑ Vauquelin, L. N.; Thenard, L.J.; Gay-Lussac, J.L. (1826). «Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance» [Report on a memoir by Mr. Balard regarding a new substance]. Annales de Chimie et de Physique. 2nd series (en francés) 32: 382-384.
- ↑ On page 341 of his article, A. J. Balard (1826) "Mémoire sur une substance particulière contenue dans l'eau de la mer" [Memoir on a peculiar substance contained in sea water], Annales de Chimie et de Physique, 2nd series, vol. 32, pp. 337–381, Balard states that Mr. Anglada persuaded him to name his new element brôme. However, on page 382 of the same journal – "Rapport sur la Mémoire de M. Balard relatif à une nouvelle Substance" [Report on a memoir by Mr. Balard regarding a new substance], Annales de Chimie et de Physique, series 2, vol. 32, pp. 382–384. – a committee of the French Academy of Sciences claimed that they had renamed the new element brôme.
- ↑ Wisniak, Jaime (2004). «Antoine-Jerôme Balard. The discoverer of bromine». Revista CENIC Ciencias Químicas 35 (1): 35-40. Archivado desde el original el 25 de marzo de 2016. Consultado el 11 de enero de 2022.
- ↑ Greenwood y Earnshaw, p. 790
- ↑ Barger, M. Susan; White, William Blaine (2000). «Technological Practice of Daguerreotypy». The Daguerreotype: Nineteenth-century Technology and Modern Science. JHU Press. pp. 31-35. ISBN 978-0-8018-6458-2.
- ↑ a b Greenwood and Earnshaw, pp. 809–12
- ↑ Greenwood y Earnshaw, pp. 812-6
- ↑ Greenwood and Earnshaw, pp. 821–4
- ↑ Greenwood y Earnshaw, pp. 824-8
- ↑ Perry, Dale L.; Phillips, Sidney L. (1995), Handbook of Inorganic Compounds, CRC Press, p. 74, ISBN 978-0-8493-8671-8, consultado el 25 de agosto de 2015.
- ↑ Greenwood and Earnshaw, pp. 850–1
Enlaces externos[editar]
 Wikimedia Commons alberga una galería multimedia sobre Bromo.
Wikimedia Commons alberga una galería multimedia sobre Bromo.- WebElements.com - Bromine
- EnvironmentalChemistry.com - Bromine
- Instituto Nacional de Seguridad e Higiene en el Trabajo de España: Ficha internacional de seguridad química del bromo.

