Cristalografía de rayos X

La cristalografía de rayos X es una técnica experimental para el estudio y análisis de materiales, basada en el fenómeno de difracción de los rayos X por sólidos en estado cristalino.
Los rayos X interactúan con los electrones que rodean los átomos por ser su longitud de onda del mismo orden de magnitud que el radio atómico. El haz de rayos X emergente tras esta interacción contiene información sobre la posición y tipo de átomos encontrados en su camino. Los cristales, gracias a su estructura periódica, dispersan elásticamente los haces de rayos X en ciertas direcciones y los amplifican por interferencia constructiva, originando un patrón de difracción.[n. 1] Existen varios tipos de detectores especiales para observar y medir la intensidad y posición de los rayos X difractados, y su análisis posterior por medios matemáticos permite obtener una representación a escala atómica de los átomos y moléculas del material estudiado.
Max von Laue realizó los primeros experimentos de cristalografía de rayos X en 1912. Von Laue, William Henry Bragg y William Lawrence Bragg desarrollaron inicialmente la teoría de difracción de cristales, tarea a la que pronto se sumaron otros científicos. A lo largo del siglo XX tuvieron lugar varios avances teóricos y técnicos, como la aparición de los superordenadores y el uso de sincrotrones para la producción de rayos X, que resultaron en un creciente capacidad del método para determinar las propiedades estructurales de todo tipo de moléculas: sales, materiales inorgánicos complejos, proteínas y hasta componentes celulares como los ribosomas. Es posible trabajar con monocristales o con polvo microcristalino, consiguiéndose diferentes datos en ambos casos. Para las aplicaciones que requieren solo una caracterización precisa de los parámetros de la red cristalina, puede ser suficiente la difracción de rayos X por polvo; para una dilucidación precisa de las posiciones atómicas se prefiere trabajar con monocristales.
La mayor limitación de este método es la necesidad de trabajar con sistemas cristalinos, por lo que no es aplicable a disoluciones, a sistemas biológicos in vivo, a sistemas amorfos o a gases. En algunos casos, los rayos X pueden romper los enlaces químicos que mantienen la integridad estructural, lo que resulta en un modelo distorsionado de la molécula estudiada. Este problema afecta especialmente a los materiales de interés biológico.
Historia
Primeros experimentos
La idea de que los cristales eran una repetición periódica de un grupo de moléculas ya existía anteriormente a que Wilhelm Conrad Röntgen descubriera los rayos-X en 1895. Aunque las distancias típicas entre los planos del la red cristalina se desconocían, se sabía que debían ser muy pequeñas comparadas con la longitud de onda de la luz visible. Esto dio la idea al físico alemán Max von Laue de utilizar cristales de sulfato de cobre para determinar si los rayos X se componían de partículas u ondas: dedujo que, si fueran ondas, deberían generar un patrón de difracción al atravesar los cristales.[n. 2] Los experimentos se realizaron en 1912, con la ayuda de Walter Friedrich y Paul Knipping, ambos antiguos estudiantes de Röntgen. Estos experimentos confirmaron la presencia de difracción cristalina.
Poco después, los británicos William Henry Bragg y William Lawrence Bragg (padre e hijo respectivamente) reprodujeron el experimento. W.L. Bragg explicó la difracción como la interferencia de los rayos X reflejados por el cristal, introduciendo la descripción conocida desde entonces como la ley de Bragg.[1] En 1913, Paul Ewald demostró que las dos interpretaciones de los resultados publicadas independientemente por von Laue y Bragg eran equivalentes.[2] Von Laue recibió el premio Nobel de Física en 1914 por su descubrimiento del fenómeno, y los Bragg recibieron el premio un año más tarde por su trabajo en las aplicaciones prácticas.[n. 3][3]Hacia el final de la década, se había logrado determinar las longitudes de onda de los rayos X y la estructura de varios compuestos inorgánicos simples y las bases teóricas de la técnica se habían establecido gracias al trabajo de los ya mencionados investigadores, Charles Galton Darwin[n. 4] y Peter Debye, entre otros.
El desarrollo de la técnica: 1920-1960
El período entre 1920 y 1960 se caracterizó por importantes adelantos metodológicos que propiciaron el empleo de la diffracción de rayos X para analizar estucturas de moléculas más complejas.
Durante la década de los 20, los avances de la teoría cuántica sirvieron para caracterizar más precisamente la interacción entre los rayos X y los átomos de los cristales; esto posibilitó el análisis correcto de la intensidad de la difracción. En la misma época aparecieron las tablas para determinar la simetría cristalina a partir de la distribución de reflexiones en el patrón de difracción y se empezaron a usar las series de Fourier para representar la distribución de electrones en la red cristalina. Los desarrollos en la representación matemática de la densidad electrónica continuaron hasta la Segunda Guerra Mundial, facilitando la obtención de las primeras estructuras de moléculas orgánicas. En 1935, el cristalógrafo británico Arthur Patterson descubrió un truco matemático para obtener las distancias interatómicas directamente a partir de los datos experimentales, lo que supuso un importante avance en el análisis de la difracción.[4]
Entre los años 40 y 60, surgieron otros procedimientos para la determinación de estructuras, con especial énfasis en métodos heurísticos basados en el proceso de ensayo y error, que demostraron ser bastante robustos en combinación con restricciones condicionantes basadas en las propiedades físicas de una estructura correcta, como por ejemplo, que la densidad electrónica debe ser siempre positiva. En este período la cristalografía empezó a adquirir importancia en el campo de la química orgánica, proceso que culminó con la determinación en 1957 de la estructura de la vitamina B12, un proyecto liderado por Dorothy Hodgkin.[4]
Avances en cristalografía de macromoléculas: 1960-1980
El evento de más impacto durante las décadas de los 60 y 70 fue el reconocimiento de la cristalografía de proteínas y de moléculas biológicas en general como área de investigación clave en la biología molecular. El año 1962 marcó un hito al otorgarse dos premios Nobel por los resultados obtenidos usando métodos cristalográficos en esta área: El premio Nobel de Química fue concedido a Max Perutz y John Kendrew por sus estudios cristalográficos de las proteínas hemoglobina y mioglobina y el premio Nobel de Medicina a Francis Crick, James Watson y Maurice Wilkins por descubrir que el ADN forma una doble hélice.[n. 5] En 1964 Dorothy Hodgkin también obtuvo el premio Nobel de Química por la determinación de varias estructuras de importancia biológica, como la penicilina y la vitamina B12, entre otras.[6]
Un adelanto que facilitó en gran medida el éxito de las técnicas cristalográficas tanto en los casos más complejos como en el de moléculas de menor tamaño fue el desarrollo de ordenadores digitales; gracias a ellos fue posible usar programas para medir y analizar fácilmente los datos obtenidos en los experimentos en vez de realizar los laboriosos cálculos manualmente.[7] Sin embargo, al final de este período el estudio de proteínas estaba aún limitado por la ausencia de fuentes de rayos X intensos y el empleo de película fotográfica para medir los patrones de difracción, lo que requería un largo proceso de revelado y digitalización de las imágenes.[n. 6] A consecuencia de estas limitaciones, y a pesar del reconocimiento generalizado del potencial de la cristalografía para estos experimentos, a finales de los años 70 el Banco de Datos de Proteínas solo contaba con unas sesenta entradas.[8]
Expansión y madurez: 1980-2010
Los tubos de rayos X, con sucesivas mejoras, se utilizaron como la fuente primordial de rayos X para los experimentos de cristalografía desde sus comienzos hasta la década de 1970, época en la que se empezó a experimentar con la radiación sincrotrón de rayos X. Los sincrotrones dedicados exclusivamente a la producción de rayos X aparecieron en los años 80 y su número no ha dejado de aumentar desde entonces.[n. 7] En la primera década del siglo XXI se construyeron los primeros láseres de electrones libres de rayos-X, capaces de producir haces de luz pulsada de una intensidad de órdenes de magnitud mayor que en las fuentes de luz sincrotrón convencionales. La duración de los pulsos de luz, del orden de femtosegundos ofrece la posibilidad de observar cambios en los cristales a escalas temporales inalcanzables anteriormente.[7] Durante estos años también se desarrollaron nuevos detectores bidimensionales o «de área», capaces de generar directamente una imagen digitalizada del patrón de difracción. Estos detectores facilitaron la rápida medición y análisis de la difracción y sustituyeron totalemente a las placas fotográficas usuadas hasta entonces.
Estos avances tecnológicos, unidos al incremento de la capacidad de los ordenadores modernos para almacenar y procesar datos, han permitido llevar a cabo experimentos antaño irrealizables, y han desembocado en un aumento exponencial del número de estructuras elucidadas por métodos cristalográficos. Los avances más notables han tenido lugar en el área de las macromoléculas orgánicas, con más de 78 000 estructuras depositadas en el Banco de Datos de Proteínas al comienzo de 2012.[8] La obtención en 2000 de la estructura del ribosoma,[9] un enorme complejo de ácidos nucleicos y varias proteínas donde tiene lugar la síntesis de proteínas en la célula, ilustra las capacidades que ha alcanzado la técnica.
Aspectos físicos
Cristales y redes cristalinas

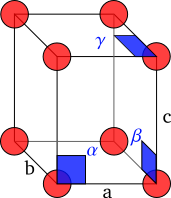
Los cristales están formados por una repetición periódica de moléculas en tres dimensiones. El cristal se puede representar matemáticamente como una red tridimensional, llamada red de Bravais en la que todas las intersecciones son idénticas.[10][11] El paralelepípedo definido por las líneas entre las intersecciones de la red se conoce como la celda unidad.[12][11] La celda unidad se define por la longitud de sus lados , y en la dirección de los tres ejes espaciales y los ángulos , y que los ejes de la red forman entre sí. Las coordenadas de cualquier punto de la red cristalina se pueden expresar como una combinación lineal de los vectores , y .[13]
La posición de un átomo en la celda unidad se expresa como coordenadas fraccionales de , y :
con las coordenadas (, , ) comprendidas entre 0 y 1.[14]
El objetivo de los experimentos de difracción por rayos X es, averiguar las coordenas , y para cada átomo. Para lograrlo es necesario, en primer lugar, determinar la relación entre la red cristalina y la geometría del patrón de difracción y, en segundo lugar, obtener las posiciones de los átomos a partir de la intensidad de la difracción.
Rayos X

Los rayos X son un tipo de radiación electromagnética con longitudes de onda entre 10 y 10-2 nm o energías entre 0.1 y 100 keV.[15] Para los experimentos de difracción cristalina se suelen usar rayos X de energía relativamente alta, del orden de 10 keV, correspondiente a longitudes de onda del orden de 0.1 nm.[16][17]
Los rayos X se describen matemáticamente como una onda sinusoidal propagándose a través del espacio. Tomando un punto arbitrario como origen, el valor del campo eléctrico en función del tiempo se puede escribir como:[18][19]
es la amplitud de la oscilación, la longitud de onda y la velocidad de la luz. Al interactuar con los electrones agrupados alrededor de los átomos de la muestra a estudiar la onda sufre un desfase con respecto a la onda en el origen:
La diferencia de fase depende de la distancia entre el punto de origen y los átomos del material; esto implica que la estructura atómica, es decir, las posiciones que ocupan los átomos, se pueden derivar de la fase de los rayos X que han atravesado el material.
Dispersión elástica de rayos X
El fenómeno de difracción cristalina tiene su origen en la dispersión elástica o scattering elástico del haz de rayos X por los átomos del cristal.[n. 8] En este tipo de interacción, el electrón desvía la trayectoria de los rayos X, conservando tanto estos como el electrón su energía inicial. La trayectoria de los rayos X es exactamente la misma que toma un rayo de luz visible reflejado en un espejo, es decir, los rayos dispersados emergen a un ángulo con respecto a la dirección de los rayos incidentes.[20]
La dispersión elástica por un grupo de átomos en una dirección dada se puede cuantificar con una cantidad conocida como factor de estructura que es igual a la suma de los rayos reflejados por cada átomo que interactúa con los rayos incidentes:
es una función llamada factor de forma — o factor de dispersión — atómico que describe la dispersión por todos los electrones del átomo en conjunto. La dispersión elástica atómica depende del número atómico y del ángulo de incidencia de los rayos X.[21] El cambio de fase de los rayos dispersados durante la interacción viene dado por el producto escalar de , el vector entre el origen y cada átomo y , el vector de dimensión en la dirección perpendicular al plano virtual de reflexión.
Difracción cristalina
Ley de Bragg
El fenómeno de difracción es debido esencialmente a la relación entre las fases de todas las ondas reflejadas por cada celda unidad del cristal: las diferencias de camino óptico entre los rayos que han atravesado distintos puntos del cristal, que a su vez producen un cambio en la amplitud de la onda resultante. Cuando las ondas están completamente desfasadas se anulan entre sí. Por el contrario, cuando las ondas están en fase, la amplitud de la onda final es la suma de las amplitudes para cada onda. Puesto que un cristal está compuesto de miles de celdas unidad, la interferencia constructiva entre todas ellas llega a resultar en un haz lo suficientemente intenso para poder ser medido con un detector de rayos X.

La condición para que las ondas estén en fase es que la diferencia de sus caminos ópticos sea cero o un múltiplo entero de la longitud de onda. En un cristal, la diferencia en el camino óptico entre átomos situados en posiciones equivalentes en distintas celdas unidad es donde es la distancia entre los planos imaginarios que unen los puntos equivalentes de la red cristalina. Es decir, para que se observe difracción de rayos X a un ángulo de observación , se debe cumplir la expresión conocida como Ley de Bragg:[22]
Como en el caso de la dispersión elástica por un átomo, la difracción cristalina se puede interpretar como la reflexión especular de los rayos X por todos los planos del cristal paralelos entre sí separados por la distancia que cumple la ley de Bragg. Por este motivo, los puntos del patrón de difracción se denominan «reflexiones».[23]

Índices de Miller
Para que se cumpla la ley de Bragg para un grupo de planos de reflexión paralelos, estos deben cruzar los ejes de la celda unidad un número entero de veces. Las reflexiones cristalinas se identifican mediante tres números , y iguales al número de intersecciones de los planos con los ejes , y de la celda. Los números , y reciben el nombre de índices de Miller. Matemáticamente los índices de Miller describen un vector perpendicular al plano de reflexión en el sistema de coordenadas definido por la red cristalina.[24]
La red recíproca
La red recíproca es una construcción matemática que facilita la representación de los planos de reflexión y la visualización de la relación entre la orientación del cristal y el patrón de difracción. Las coordenadas de cada punto de la red recíproca coinciden con los índices de Miller, es decir, cada punto de la red recíproca representa a una familia de planos de Miller en el espacio real de la red cristalina; la distancia del origen a cada punto de la red es .[25][26]
Al igual que en el caso de la red cristalina, los puntos de la red recíproca se pueden expresar como una combinación lineal de vectores , y :[25]
La relación entre los parámetros de la celda unidad (, , , , , ) de volumen y la celda unidad recíproca (, , , ,, ) es la siguiente:[27][26]

La esfera de Ewald
Para visualizar fácilmente los planos de Miller que contribuyen a la difracción en una dirección dada y determinar la relación entre la orientación del cristal y el patrón de difracción, se utiliza la construcción conocida como esfera de Ewald. La esfera de Ewald ilustra todas las posibles direcciones en que los rayos X pueden ser reflejados por el cristal. El radio de esta esfera es y su extremo en la dirección del haz de rayos X incidente coincide con el origen de la red recíproca.[23][25]
Si un punto de la red recíproca de coordenadas se encuentra sobre la superficie de la esfera de Ewald, los planos de Miller con índices darán lugar a un punto de difracción en la dirección definida por el centro de la esfera y ese punto de la red recíproca. La distancia entre el origen y es , por lo que se puede demostrar geométricamente que esta condición de difracción es equivalente a la ley de Bragg.[25]
El factor de estructura cristalino
El vector con coordenadas en la red recíproca, es perpendicular al plano de reflexión y tiene amplitud ; es decir, es el vector introducido en la definición del factor de estructura para un conjunto de átomos. Por lo tanto, el factor de estructura en la dirección definida por los planos de Miller descritos por los índices se reformula como:[28][n. 9]
donde es el vector de coordenadas del átomo en el sistema definido por la celda unidad y la suma se realiza para todos los átomos contenidos en ella. En lugar de sumar las contribuciones de cada átomo, también se puede realizar una integración sobre los electrones en el volumen de la celda unidad, cuya distribución se representa por la función de densidad electrónica :[29]

La aplicación de las operaciones de simetría del cristal a las coordenadas resulta en relaciones de igualdad entre los factores de estructura de diferentes reflexiones. A las reflexiones así relacionadas se las denomina «simétricamente equivalentes». En los experimentos cristalográficos, donde el grupo de simetría no se conoce con certeza a priori, se comparan las intensidades de reflexiones relacionadas por diversas operaciones de simetría para caracterizar la simetría del cristal. La relación
se conoce como ley de Friedel y ocurre incluso si no existe simetría, aparte de la traslación de la celda unidad sobre la red cristalina.[30] En la práctica la ley de Friedel no se cumple exactamente debido a la presencia de interacciones inelásticas entre los rayos X y los átomos, que resultan en absorción de energía por estos.[31] Esos efectos suelen ser pequeños comparados con las interacciones elásticas y no se suelen tener en cuenta, excepto para longitudes de onda en la vecindad de una discontinuidad de absorción del cristal.
El problema de las fases
El propósito de los experimentos cristalográficos no es obtener el patrón de difracción, sino el valor de la función de distribución electrónica . Se puede demostrar que esta puede representarse como sumas de Fourier de los factores de estructura en todas las direcciones:[32]
Mientras que el módulo de los factores de estructura se puede calcular fácilmente a partir de la intensidad del punto de difracción medido por un detector sensible a los rayos X, la fase no se puede medir directamente. Esto se conoce como el «problema de las fases».[33] Existen varios métodos para resolver el problema de las fases y elucidar la estructura atómica, clasificados en los siguientes grupos:[34]
- Métodos de Patterson
- Métodos directos
- Dispersión anómala
- Reemplazamiento isomorfo
- Reemplazamiento molecular
Métodos de Patterson
La función de Patterson se calcula efectuando la síntesis de Fourier con el cuadrado de los factores de estructura como coeficientes. Esta función se puede calcular directamente a partir de los datos experimentales, al no depender de la fase de los factores de estructura. En 1935, Arthur Patterson se percató de que los máximos de esta función corresponden a los vectores que se pueden trazar entre cada par de átomos en la celda unidad, lo cual se puede utilizar en ciertos casos favorables para determinar la posición de todos o algunos átomos. En particular, el análisis de la función de Patterson se utiliza a menudo para localizar los átomos causantes de diferencias isomorfas o anómalas, lo cual es a su vez el primer paso para solucionar el problema de las fases por estos otros métodos.[35][36][37]
Métodos directos
La función de distribución de densidad electrónica se caracteriza por ser siempre positiva y alcanzar valores máximos alrededor de los átomos. Estas y otras propiedades derivadas de principios físicos básicos, expresadas en forma matemática, se utilizan para discriminar entre valores de las fases que son probables y los que no y de esta manera elucidar la estructura de la molécula de interés. Este método se usa corrientemente para resolver el problema de las fases para moléculas pequeñas.[38] En contraste, en el caso de los cristales de macromoléculas, los métodos directos no suelen ser suficientes para resolver la estructura totalmente ab initio sin ninguna información experimental adicional; esto se debe a que, por un lado, los cristales de proteínas y moléculas de similar tamaño raramente difractan a una resolución suficiente para obtener el número de reflexiones requerido para determinar todos los parámetros atómicos y, por otro lado, al gran número de átomos en la celda unidad, que causa que las relaciones entre las probabilidades de las fases sean menos determinantes que en los casos de moléculas que cuentan con pocos átomos.[39][40]
A pesar de los límites del método, sus principios también se aplican en el área de difracción de macromoléculas para mejorar las fases obtenidas por otros métodos y el cálculo de las fases a partir de un modelo de baja resolución. En la cristalografía de proteínas, las propiedades claves para discriminar entre fases correctas e incorrectas incluyen:[41]
- El contraste entre las zonas de la celda unidad ocupadas por moléculas de agua o solvente en estado amorfo y las zonas ordenadas ocupadas por la molécula.
- Una distribución característica de la probabilidad de valores de la densidad electrónica.
Al igual que la función de Patterson, los métodos directos también se utilizan para determinar las posiciones de átomos especiales en los métodos de sustitución o remplazamiento isomorfo y de dispersión anómala.
Reemplazamiento isomorfo
El reemplazamiento isomorfo o sustitución isomorfa es un método para resolver el problema de las fases empleado predominantemente en cristalografía de macromoléculas. Consiste en la introducción en el medio de cristalización de un compuesto químico de pequeño tamaño conteniendo un átomo pesado, es decir de un número atómico elevado. Los compuestos de mercurio, platino, uranio, y oro son los más utilizados, entre muchos otros.[42][n. 10] Para que el método tenga éxito se debe establecer un enlace químico entre la molécula de interés y el átomo pesado, y la molécula modificada o «derivada» debe formar cristales isomorfos, con la misma simetría que los obtenidos a partir de la molécula «nativa» sin modificar. El factor de estructura de la molécula derivada es la suma del factor de estructura «nativo» y la contribución del átomo pesado .
Las fases del átomo pesado que contribuyen a esto se puede deducir por métodos directos a partir de las diferencias . Aunque una sola sustitución isomorfa no es suficiente para determinar , si se repite el proceso con al menos una segunda estructura derivada diferente, es posible determinar las fases para la estructura nativa, por el método conocido como reemplazamiento isomorfo múltiple o sus siglas en inglés MIR (Multiple Isomorphous Replacement)[n. 11][43]
Las principal limitación de este método estriba en la dificultad de encontrar compuestos que reaccionen con la molécula a estudiar sin destruir al mismo tiempo el cristal o modificar sensiblemente su simetría o las dimensiones de la celda unidad.
Dispersión anómala
El factor de forma atómica no solo describe la dispersión elástica sino también el efecto fotoeléctrico, que tiene lugar cuando los electrones cambian su estado cuántico al absorber parte de la energía de los rayos X. El término que corresponde a la dispersión inelástica o «anómala» es un número complejo .[44] Ambas componentes real e imaginaria alteran la magnitud de los factores de estructura. La componente imaginaria, relacionada con el coeficiente de absorción, introduce además un cambio de fase que resulta en diferentes magnitudes de los pares Friedel y , idénticas en ausencia de este efecto.
La contribución anómala al factor de estructura es menor que la contribución elástica y a menudo no es necesario tenerla en cuenta. Sin embargo, depende de la longitud de onda de los rayos X y experimenta grandes variaciones cuando la energía del haz incidente es similar a la energía de un nivel atómico del átomo. Cuando y alcanzan sus valores máximos los cambios en la magnitud y fase de los factores de estructura pueden ser significativos. Si algunos átomos en la molécula resultan afectados por este tipo de interacción, se pueden hallar sus posiciones en la celda unidad analizando las diferencias en la intensidad entre las reflexiones medidas a distintas longitudes de onda, o entre los pares de Friedel a la misma longitud de onda. Dichas diferencias se pueden utilizar para resolver el problema de las fases, por el método MAD (Multiwavelength Anomalous Dispersion o ‘dispersión anómala a múltiples longitudes de onda’)[45] o SAD (Single-wavelength Anomalous Dispersion o ‘dispersión anómala a una sola longitud de onda’)[n. 12]
La mayoría de los átomos pesados usados en el método de reemplazamiento isomorfo exhiben una dispersión anómala importante en el rango de longitudes de onda usadas en los experimentos cristalográficos, por lo cual estas dos técnicas se pueden usar en conjunción. La ventaja de los métodos basados en la dispersión anómala es que, al precisar en principio solo un cristal para determinar las fases, no están limitados por un isomorfismo imperfecto. El uso de radiación sincrotrón, que se puede sintonizar a las longitudes de onda que optimizan la dispersión anómala, ha resultado en un fuerte incremento de la popularidad del método.
Reemplazamiento molecular
El método de reemplazamiento molecular consiste en usar una molécula de estructura conocida para calcular las fases iniciales de una segunda molécula con elementos estructurales comunes con la primera. Este es el método más usado para determinar la estructura de macromoléculas como las proteínas, ya que muchas de ellas se agrupan en familias con una estructura similar o forman complejos supramoleculares en los que se conoce la estructura de una o más componentes.[47][48]
Una desventaja de este método es que las fases obtenidas están sesgadas hacia la estructura utilizada como punto de partida. Esto no ocurre con las técnicas basadas enteramente en los datos de difracción experimentales y consideraciones químicas o estructurales generales. El éxito de este método depende de procedimientos sofisticados para detectar y eliminar este sesgo durante el refinamiento de las fases, evitando que algunas diferencias importantes entre las dos moléculas pueden pasar desapercibidas.[48]

Refinamiento de la estructura
Una vez calculada la función a partir de las fases, se puede construir un modelo de la estructura en el mapa de densidad electrónica. Este modelo se describe por un número de parámetros: las posiciones de cada átomo , y , su factor de temperatura representando los deplazamientos de los átomos con respecto a su posición media, etc.[49][n. 13] La determinación inicial de estos parámetros puede ser incorrecta, debido a errores en la determinación de las fases o fallos de interpretación de la densidad electrónica.[50]Durante el refinamiento se compara el módulo de los factores de estructura calculados a partir del modelo con el de los derivados del experimento , y se modifican gradualmente los parámetros hasta que la diferencia sea la menor posible. La figura de mérito utilizada para la comparación es el factor R, definido como:[51]
La suma se realiza sobre todas las reflexiones .
Se usan dos técnicas matemáticas para ajustar los parámetros del modelo durante el refinamiento: los mínimos cuadrados y la máxima verosimilitud. El segundo método requiere más recursos computacionales, pero es más general y se aplica con preferencia en problemas difíciles, como macromoléculas y difracción a baja resolución.[52][53]
Adquisión de datos
Fuentes de rayos X

Los experimentos de cristalografía de rayos X se pueden realizar, o bien con un tubo de rayos X o usando la radiación sincrotrón emitida por aceleradores de partículas. En los tubos de rayos X, un haz de electrones producidos por calentamiento de un filamento de wolframio — el cátodo— se aceleran mediante un voltaje aplicado a lo largo del tubo y colisionan contra un material metálico, el ánodo. Los electrones desacelerados, emiten radiación de Bremsstrahlung de espectro continuo — compuesta de múltiple longitudes de onda.— El ánodo absorbe parte de los rayos X emitidos por los electrones y emite a su vez rayos X de las longitudes de onda características del metal. Por ejemplo, un ánodo de cobre emite principalmente en la longitud de onda de 1.5405 Å. La radiación de Bremsstrahlung y otras líneas de emisión características menos intensas se filtran con un metal absorbente. En el ejemplo del ánodo de cobre, se utiliza níquel, que es bastante transparente a los rayos X de 1.5405 Å pero absorbe eficazmente la radiación a longitudes de onda menores, obteniéndose un haz de rayos X bastante monocromático.[54] Los rayos de tubos X son relativamente baratos y los laboratorios de investigación los suelen utilizar para realizar experimentos in situ.
La radiación sincrotrón se obtiene cuando un haz de electrones[n. 14] acelerados hasta alcanzar una velocidad cercana a la de la luz son desviados de su trayectoria por medio de un campo magnético. La radiación sincrotrón es de espectro continuo y la longitud de onda deseada para el experimento se puede seleccionar mediante un monocromador. Las fuentes de radiación sincrotrón emiten rayos X mucho más intensos que los rayos de tubos X y son necesarias para mejorar la calidad de la difracción para cristales muy pequeños o compuestos de átomos muy ligeros, que interaccionan débilmente con los rayos X.
Detectores
Existen varios tipos de detectores usados en los experimentos de cristalografía. El detector bidimensional más usado durante mucho tiempo fue la película fotográfica, actualmente reemplazada por otros detectores más sensibles a los rayos X. Otro detector clásico es el contador proporcional unidimensional, normalmente un detector de centelleo, instalado en un difractómetro y controlado por ordenador. Este tipo de detector mide las reflexiones una a una y todavía se usa para la cristalografía de moléculas pequeñas, pero es poco eficaz en los experimentos con macromoléculas, donde el número de reflexiones ronda entre 10 000 y 100 000.[55]
A partir de los años 1990 empezaron a aparecer nuevos detectores, como las «placas de imagen» (image plates). Las placas de imagen están recubiertas de un material fosforescente, donde los electrones incrementan su energía al absorber los rayos X difractados y son atrapados en este nivel en centros de color. Los electrones liberan la energía al iluminarse la placa con luz láser, emitiendo luz con intensidad proporcional a la de la reflexión. Estos detectores son un orden de magnitud más sensibles que la película fotográfica y poseen un margen dinámico superior en varios órdenes de magnitud, lo que facilita la medición simultánea de las reflexiones más intensas y las más débiles. Otros detectores usados en la actualidad son detectores electrónicos, conocidos como detectores «de área», que procesan la señal inmediatamente tras la detección de los rayos X. Pueden ser cámaras de ionización o una placa fosforescente acoplada a una cámara CCD.[56] En los años 2000 se empezaron a utilizar fotodiodos alineados formando una placa, denominados PAD (Pixel Array Detectors). Estos detectores se caracterizan por un gran margen dinámico y un tiempo muerto entre imágenes muy bajo, del orden de milisegundos.[57]
Geometrías de difracción
Existen tres métodos para medir la difracción de rayos X: el método de Laue, el método de rotación y el método de polvo.
Método de Laue

Consiste en hacer incidir en un cristal un espectro continuo de rayos X, de tal manera que para cada longitud de onda se cumple la ley de Bragg para diferentes puntos de la red recíproca. Esto posibilita medir todas o casi todas la reflexiones sin cambiar la orientación del cristal. Existen dos variantes del método de Laue: transmisión y reflexión. En el método de Laue por transmisión, el cristal se emplaza entre la fuente de rayos X y el detector. En método de reflexión, el detector se encuentra entre la fuente y el cristal, para detectar los haces difractados hacia atrás.[58]
A pesar de ser el método utilizado en los primeros experimentos cristalográficos, el método de Laue se usaba muy poco para la determinación de estructuras debido principalmente a la baja intensidad de la radiación de espectro continua producida por los tubos de rayos X en comparación con la emisión característica monocromática. El creciente uso de la radiación sincrotrón ha fomentado el resurgimiento del método. La capacidad de medir todos los datos necesarios para la determinación de la estructura en un corto tiempo lo convierte en el método más apropiado para el estudio de reacciones químicas que tienen lugar en pocos segundos, como catálisis por enzimas y zeolitas y los efectos de perturbaciones causadas por campos eléctricos, cambios de presión y temperatura, etc. en diversos materiales.[59]
Métodos de rotación de cristal


Se hace incidir un haz de rayos X monocromáticos sobre un cristal, que rota a una velocidad constante alrededor de un eje perpendicular a los rayos X. La rotación del cristal causa que todos los puntos de la red recíproca atraviesen consecutivamente la esfera de Ewald, logrando así medir las reflexiones necesarias. Existen diferentes variantes de este método. En el método de Weissenberg se usa una cámara de forma cilíndrica rodeando al cristal tal que el eje de rotación del cristal coincide con el eje del cilindro. La cámara se traslada a medida que el cristal gira para que las reflexiones estén separadas. En el método de precesión, la cámara es plana, y rota alrededor de un eje paralelo al eje de rotación del cristal. En ambos métodos se usa una pantalla para medir solo una sección bidimensional de la red recíproca en cada imagen.[60][61] Estos métodos facilitan la determinación de la orientación del cristal y los índices de las reflexiones, pero son lentos e ineficientes. Los avances en computación de los años 90 posibilitaron un diseño más simple, en el que el detector se mantiene estacionario detrás del cristal, usándose programas para hallar automáticamente la orientación y los parámetros cristalinos consistentes con el patrón de difracción observado.[62]
Método de polvo cristalino

En el método de polvo cristalino o de Debye-Scherrer,[n. 15] el cristal a analizar es pulverizado de tal manera que forme un conjunto de microcristales en todas las posibles orientaciones de la red recíproca. Con esta geometría todas las reflexiones se pueden medir en un solo patrón de difracción, consistente en círculos, uno para cada reflexión. Aunque el método de rotación de cristal resulta en valores más exactos de la intensidad de las reflexiones, el método de polvo es a veces la única opción cuando el material a estudiar no forma monocristales de un tamaño suficiente para producir difracción detectable. Este método se usa mayoritariamente cuando no es necesario determinar la estructura; por ejemplo, en el análisis de minerales presentes en una muestra.[63]
Aplicaciones
La cristalografía tiene muchas aplicaciones en una gran variedad de disciplinas científicas, como la mineralogía, química, biología molecular, farmacología, geología, física aplicada y ciencia de materiales.[64][65] Entre los numerosos premios Nobel asociados a la cristalografía,[66] una alta proporción se han concedido a aplicaciones de difracción por rayos X o desarrollo metodológico relacionados con esta técnica. La información obtenida a partir de experimentos cristalográficos también se utiliza en campos no directamente relacionados con la investigación científica básica o el desarrollo tecnológico, como la ciencia forense o la historia del arte.[67]
Análisis de minerales
La cristalografía de rayos X se utiliza no solo para obtener estructuras desconocidas, sino también para determinar la composición de muestras de suelos o minerales, así como para la identificación de metales y otros elementos. Cada sustancia mineral forma cristales con una celda unidad y simetría determinada, que resulta en un patrón de difracción característico. La difracción por el método de polvo es muy usada para este tipo de aplicaciones, por ser sencillo comparar el espaciado entre los anillos de difracción con los valores compilados por el Joint Committee on Powder Diffraction Standars (JCPDS).[63] Las proporciones relativas de dos o más minerales presentes en una misma muestra se obtienen comparando las intensidades de sus respectivas líneas con aquellas de muestras de composición conocida. Un ejemplo de esta aplicación es la identificación de minerales arcillosos, la fracción del suelo cuyas partículas minerales tienen un tamaño inferior a 2 μm.[68][69]
Diseño de fármacos
Desde finales de siglo XX se ha empezado a diseñar nuevos fármacos y medicamentos basados en inhibidores y sustratos naturales de diversas proteínas y enzimas involucradas en ciclos celulares y metabólicos. El conocimiento de la estructura de la parte de la proteína — la forma y la distribución de cargas electrostáticas — que liga estos compuestos facilita este proceso, gracias a la mejor comprensión de las interacciones entre la proteína y el ligando de interés; esto permite concentrarse en el diseño de fármacos con las características específicas deseadas.[70] Uno de los ejemplos más importantes de esta aplicación es el compuesto vemurafenib, diseñado para bloquear una enzima mutante presente en el 60% de los casos de melanoma.[71]
Limitaciones
La limitación fundamental de la cristalografía de rayos X consiste en que sólo puede aplicarse a sustancias susceptibles de formar cristales. Aunque las técnicas cristalográficas pueden utilizarse también para determinar la estructura de otros materiales con periodicidad espacial, como fibras helicoidales —ADN, algunos tipos de virus, etc.— y cuasicristales, resulta imposible estudiar gases, líquidos y sólidos desordenados por este método. Además, la obtención de cristales no es siempre suficiente para obtener la estructura de interés: las moléculas de tamaño grande, por ejemplo, suelen ser casos difíciles.[72]

Otro límite de la técnica está relacionado con el tipo de información que proporciona sobre la estructura: Los modelos obtenidos por difracción representan una media de las posiciones atómicas para todas las moléculas del cristal; cuando la molécula cuenta con átomos que oscilan entre diferentes conformaciones, la densidad electrónica media se extiende sobre la totalidad del espacio que pueden ocupar estos átomos y las partes desordenadas de la molécula resultan invisibles. Esto representa un serio problema para el estudio de enzimas si el sitio activo de la molécula —asociada a su actividad química— presenta una gran movilidad; en este caso la determinación de las propiedades de materiales biológicos in vivo a partir de su estructura cristalina es problemática y requiere métodos de estudio alternativos, como la resonancia magnética nuclear.
Las vibraciones atómicas también limitan la resolución alcanzable con los datos de difracción, incluso cuando las moléculas adoptan la misma conformación en distintas celdas unidad. La resolución del modelo no suele ser suficiente para determinar el estado de oxidación, posicionar todos los átomos de hidrógeno o distinguir elementos con números atómicos semejantes.[72][73] La débil interacción de los rayos X con los átomos ligeros es otra desventaja de la técnica en aplicaciones, como la caracterización de nanomateriales.[74]
Finalmente, las propiedades ionizantes de los rayos X pueden alterar o destruir las moléculas del cristal durante el experimento. Cuando esto ocurre, el modelo obtenido no refleja la verdadera estructura molecular y puede dar lugar a interpretaciones erróneas sobre sus propiedades. Además, las distorsiones globales de la red cristalina y otros efectos secundarios de la irradiación dificultan la obtención de las fases. Este problema es grave en cristales de proteínas, que contienen una alta proporción de agua y compuestos orgánicos fácilmente radiolizables, y un gran número de enlaces químicos susceptibles al ataque por los radicales libres y electrones producidos por dicha radiolisis. los experimentos con moléculas biológicas se suelen realizar a temperaturas de 100 K o menores; esto frena la difusión de los radicales libres, aunque no soluciona enteramente el problema, pues los fotoelectrones excitados por los rayos X permanecen móviles hasta el cero absoluto.[75][76]
Véase también
- Cristalografía
- Difracción de electrones
- Difracción de neutrones
- Espectroscopia de rayos X
- Resonancia magnética nuclear
Notas
- ↑ El término 'difracción de rayos X' se utiliza a menudo para referirse a la aplicación de este fenómeno a la cristalografía; sin embargo, es posible observar difracción por materiales no cristalinos. Por ejemplo, la estructura de la doble hélice de ADN se elucidó por primera vez usando datos de difración de rayos X por fibras deshidratadas de ADN.
- ↑ Esta cuestión fue resuelta definitivamente cuando de Broglie introdujo en 1924 el concepto de la dualidad onda partícula.
- ↑ Debido al comienzo de la Primera Guerra Mundial, en la que Suecia deseaba mantenerse estrictamente neutral y no dar la impresión de que se favorecía a ningún país contendiente, los premios no fueron otorgados hasta después de la guerra.
- ↑ Nieto de Charles Darwin, autor de El origen de las especies.
- ↑ Rosalind Franklin, que realizó el análisis de los datos de difracción cruciales para determinar la estructura de la doble hélice, falleció antes de que se concediera el premio.[5]
- ↑ La medición individual de reflexiones de rayos X emergentes en diferentes direcciones con un fotodetector unidimensional, que facilitó la automatización de los experimentos con moléculas pequeñas durante este periodo no resultaba práctica en el caso de moléculas con muchos átomos, debido a la enorme cantidad de reflexiones presentes en este caso.
- ↑ Véase la lista en Anexo:Fuentes de luz sincrotrón.
- ↑ Desde el punto de vista de la electrodinámica cuántica, la dispersión elástica es simplemente un caso especial del efecto Compton.
- ↑ La nomenclatura usada para designar al factor de forma cristalino varía; a menudo aparece como . Otras denominaciones comunes son , y . Las dos últimas son más utilizadas para describir la difracción en general que en el caso específico de la difracción cristalina.
- ↑ El factor de forma atómico f es proporcional al número atómico, por lo que la contribución al factor de estructura de un átomo pesado es significantemente mayor que la de los átomos ligeros (carbono, oxígeno, nitrógeno e hidrógeno) predominantes en las macromoléculas orgánicas.
- ↑ En ocasiones, si hay errores en los datos debidos a un isomorfismo imperfecto entre los cristales u otros factores, es necesario usar más de dos derivados para obtener fases lo suficientemente exactas.
- ↑ Se necesitan al menos dos longitudes de onda diferentes para resolver el problema de las fases solamente por este método, pero una longitud de onda basta si se aplican restricciones adicionales sobre la función de densidad electrónica.[46]
- ↑ El número de parámetros usados para representar el modelo depende de la resolución de la difracción. Para que el refinamiento sea efectivo, el número de reflexiones independientes —no relacionadas por simetría— debe ser mayor que los parámetros que se pretenden refinar.
- ↑ Es posible usar positrones u otra partícula con carga eléctrica para este fin, pero se usan electrones en la mayoría de los casos.
- ↑ Este método fue propuesto por Peter Debye y Paul Scherrer en 1916 e independientemente por Albert Hull en 1917.[4]
Referencias
- ↑ Bragg, William Lawrence Bragg (1913). Proc. Cambridge Philos. Soc. (en inglés) 17: 43-57.
- ↑ Ewald, Paul Peter (1913). Phys. Z. 14: 465-472.
- ↑ Eckert, Michael (2012). «Disputed discovery: the beginnings of X-ray diffraction in crystals in 1912 and its repercussions». Acta Crystallographica A (en inglés) 68: 30-30. doi:10.1107/S0108767311039985.
- ↑ a b c Bragg, William Lawrence; Ewald, Paul Peter (ed.) (1962). «The growing power of X-ray analysis» (PDF). Fifty Years of X-Ray Diffraction (en inglés). International Union of Crystallography. pp. 120-135.
- ↑ Osman Elkin, Lynne (2003). «Rosalind Franklin and the Double Helix». Physics Today (en inglés) 56 (3): 42. doi:10.1063/1.1570771.
- ↑ «All Nobel Prizes by Year» (en inglés). The official web site for the Nobel Prize. Consultado el 17 de enero de 2012.
- ↑ a b Schwarzenbach, Dieter (2012). «The success story of crystallography». Acta Crystallographica A (en inglés) 68: 57-67. doi:10.1107/S0108767311030303.
- ↑ a b «RCSB Protein Data Bank» (en inglés). Consultado el 17 de enero de 2012.
- ↑ Ramakrishnan, Venki; Moore, Peter B. (2001). «Atomic structures at last: the ribosome in 2000» (PDF). Current Opinion in Structural Biology 11: 144-154.
- ↑ Universidad de Cambridge. «Lattices» (en inglés). Consultado el 22 de marzo de 2012.
- ↑ a b Stout y Jensen, 1989, pp. 18-19.
- ↑ Universidad de Cambridge. «Unit cell» (en inglés). Consultado el 22 de marzo de 2012.
- ↑ Universidad de Cambridge. «Lattice geometry» (en inglés). Consultado el 22 de marzo de 2012.
- ↑ Drenth, 1999, p. 62.
- ↑ Stout y Jensen, 1989, p. 7.
- ↑ Stout y Jensen, 1989, p. 11.
- ↑ Helliwell, 1992, pp. 268-274.
- ↑ Drenth, 1999, pp. 71-74.
- ↑ Read,Randy (2009). «Advanced diffraction: waves, interference and complex numbers». Protein Crystallography Course (en inglés). Universidad de Cambridge. Consultado el 26 de marzo de 2012.
- ↑ Drenth, 1999, p. 75.
- ↑ Ozols,Andrés (2009). «Aplicaciones de la difracción de rayos X» (PDF). Facultad de Ingeniería, Universidad de Buenos Aires. Consultado el 26 de marzo de 2012.
- ↑ IUCr (3 de febrero de 2012). «Bragg's law». Online dictionary of crystallography (en inglés). Consultado el 29 de marzo de 2012.
- ↑ a b «Ecuaciones de Laue. Ley de Bragg». Curso de cristalografía estructural. Universidad Nacional de Educación a Distancia, Facultad de Ciencias. Consultado el 29 de marzo de 2012.
- ↑ IUCr (6 de febrero de 2012). «Miller indices». Online dictionary of crystallography (en inglés). Consultado el 3 de abril de 2012.
- ↑ a b c d IUCr (25 de mayo de 2007). «Reciprocal lattice». Online dictionary of crystallography (en inglés). Consultado el 29 de marzo de 2012.
- ↑ a b Stout, Jensen, pp. 26-33.
- ↑ Authier, André. «Reciprocal lattice» (pdf). (en inglés). University College Cardiff Press, Cardiff, Wales; Versión digital: Unión Internacional de Cristalografía. ISBN 0 906449 08 I
|isbn=incorrecto (ayuda). Consultado el 11 de febrero de 2012. Parámetro desconocido|año original=ignorado (ayuda); Parámetro desconocido|tíulo=ignorado (ayuda) - ↑ IUCr (1 de septiembre de 2011). «Structure factor». Online dictionary of crystallography (en inglés). Consultado el 9 de abril de 2012.
- ↑ Stout y jensen, 1989, p. 205.
- ↑ Stout y Jensen, 1989, p. 203.
- ↑ Unión Internacional de Cristalografía. «Friedel's law». Online Dictionary of Crystallography (en inglés). Consultado el 12 de marzo de 2012.
- ↑ Stout, Jensen, p. 209.
- ↑ Elies Molins y Joan F. Piniella (1995). Determinación y aplicación de las densidades electrónicas precisas. En Félix Hernández Cano, Concepción Foces-Foces, Martín Martínez-Ripoll, ed. «Cristalografía». Colección:Nuevas Tendencias 26 (CSIC). pp. 61-62. ISBN 978-8400075576.
- ↑ Read, Randy (26 de febrero de 2012). «The phase problem: introduction to phasing methods». Protein Crystallography Course (en inglés). Cambridge University. Consultado el 12 de abril de 2012.
- ↑ Sout y Jensen, 1989, pp. 279-291.
- ↑ Luger, 1980, pp. 216-217.
- ↑ Unión Internacional de Cristalografía. «Patterson methods». Online Dictionary of Crystallography (en inglés). Consultado el 3 de abril de 2012.
- ↑ Stout y Jensen, 1989, p. 248.
- ↑ Karle, Jerome (1989). «Direct methods in protein crystallography». Acta Crystallographica A (en inglés) 45: 765-781. doi:10.1107/S0108767389007403.
- ↑ Sheldrick, George. M. (1998). S. Fortier, ed. Direct Methods for Solving Macromolecular Structures. Kluwer Academic Publishers. pp. 401-411.
- ↑ Jerónimo Bravo, Nuria Verdaguer e Ignacio Fita (1995). Modificación de la densidad electrónica en el afinamiento y extensión de las fases en macromoléculas. En Félix Hernández Cano, Concepción Foces-Foces, Martín Martínez-Ripoll, ed. «Cristalografía». Colección:Nuevas Tendencias 26 (CSIC). pp. 199-. ISBN 978-8400075576.
- ↑ Islam, Suhail A.; Carvin, David; Sternberg, Michael J. E.; Blundell, Tom L. (1998). «HAD, a Data Bank of Heavy-Atom Binding Sites in Protein Crystals: a Resource for Use in Multiple Isomorphous Replacement and Anomalous Scattering». Acta Crystallographica D (en inglés) 54: 1199-1206. doi:10.1107/S090744499800715X.
- ↑ Rupp, Bernhard (26 de diciembre de 2009). «Multiple Isomorphous Replacement (MIR) Phasing» (en inglés). Consultado el 27 de febrero de 2012.
- ↑ IUCr (3 de febrero de 2012). «Anomalous dispersion». Online dictionary of crystallography (en inglés). Consultado el 12 de abril de 2012.
- ↑ IUCr (11 de abril de 2008). «Multiwavelength anomalous diffraction (MAD)». Online dictionary of crystallography (en inglés). Consultado el 12 de abril de 2012.
- ↑ Dauter, Zbigniew; Dauter, Miroslawa; Dodson, Eleanor (2002). «Jolly SAD». Acta Crystallographica Section D 58: 494-506. doi:10.1107/S090744490200118X.
- ↑ Santiago García-Granda y Javier Borge (1995). Resolución estructural «Ab Initio» de moléculas orgánicas y proteínas por aplicación de funciones de rotación y traslación. En Félix Hernández Cano, Concepción Foces-Foces, Martín Martínez-Ripoll, ed. «Cristalografía». Colección:Nuevas Tendencias 26 (CSIC). pp. 199-. ISBN 978-8400075576.
- ↑ a b Dodson, Eleanor (2008). «The befores and afters of molecular replacement». Acta Crystallographica D 64: 17-24. doi:10.1107/S0907444907049736.
- ↑ Luger, 1980, p. 267.
- ↑ Read,Randy (2008). «Overview of macromolecular X-ray crystallography». Protein crystallography course. University of Cambridge. Consultado el 6 de abril de 2012.
- ↑ Luger,, p. 267.
- ↑ Drenth, 1999, p. 268.
- ↑ Read,Randy (2009). «Likelihood: theory and application to structure refinement». Protein crystallography course. University of Cambridge. Consultado el 6 de abril de 2012.
- ↑ Luger, 1980.
- ↑ Drenth, 1999, p. 35.
- ↑ Drenth, 1999, pp. 34-35.
- ↑ Gruner, E F; Barna, S L; Tate, M W; Rossi, G; WixtedP J Sellin, R L (1998). «A Pixel-Array Detector for Time-Resolved X-ray Diffraction». Journal of Synchrotron Radiation (en inglés): 252-255. PMID 15263487. Parámetro desconocido
|Volumen=ignorado (se sugiere|volumen=) (ayuda) - ↑ «The Laue method». Matter, Universidad de Liverpool. 25 de julio de 2000. Consultado el 27 de marzo de 2012.
- ↑ Helliwell, 1992, p. 276.
- ↑ Luger, 1980, pp. 52-79.
- ↑ Stout y Jensen, 1989, pp. 93-136.
- ↑ Jeffrey, Phil (febrero de 2006). «X-ray Data Collection Course» (en inglés). Consultado el 28 de marzo de 2012.
- ↑ a b «Métodos de difracción de rayos X». Curso de cristalografía. Universidad Nacional de Educación a Distancia, Facultad de Ciencias. Consultado el 1 de abril de 2012.
- ↑ T. Hahn, ed. (1990-1991). «Crystallography: current and future tasks» (en inglés). Deutsche Gesellschaft für Kristallographie. Parámetro desconocido
|fechacceso=ignorado (se sugiere|fechaacceso=) (ayuda) - ↑ Ibáñez Muñoz, Sonia. «¿Qué es la cristalografía de proteínas?». Consultado el 13 de abril de 2012.
- ↑ IUcr. «Nobel Prize winners associated with crystallography». Consultado el 13 de abril de 2012.
- ↑ Gabinete de comunicación de la Universidad Internacional Menéndez Pelayo (11 de agosto de 2011). «Expertos en Cristalografía lamentan la carencia de técnicos en España y apuestan por la divulgación para “fomentar las vocaciones”». Consultado el 13 de abril de 2012.
- ↑ Thorez, J. (1975). Phyllosilicates and Clay Minerals. A Laboratory Handbook for Their X-Ray Diffraction Analysis (en inglés). Lelotte.
- ↑ Iván Darío Gómez Guzmán, ed. (2006). Métodos Analíticos del Laboratorio de Suelos. Mineralogía de la Fracción Arcilla (6 edición). Colombia: IGAC (Instituto Geográfico Agustín Codazzi). ISBN 9789589067987.
- ↑ Greer, Jonathan; Erickson,, John W.; Baldwin, John J.; Varney, Michael D. (1994). «Application of the Three-Dimensional Structures of Protein Target Molecules in Structure-Based Drug Design». Journal of Medicinal Chemistry (en inglés) 37 (8): 1035-1054. doi:10.1021/jm00034a001.
- ↑ Hughes, Terry V.; Baldwin, Ian; Churcher, Ian (2012). «Fragment-based Drug Discovery - From Hit Discovery to FDA Approval: Lessons Learned and Future Challenges». International Drug Discovery.
- ↑ a b Center for Metalloenzyme studies. «X-Ray Crystallography» (en inglés). Consultado el 19 de marzo de 2012.
- ↑ Ambrus, Attila. «Comparison of NMR and X-Ray Crystallography as Methods of the Protein Structure Determination» (en inglés). Consultado el 19 de marzo de 2012.
- ↑ Suneel, Sri D. «Special nano materials, characterization and Tools» (en inglés). Consultado el 19 de marzo de 2012.
- ↑ Garman, Elspeth F. (2010). «Radiation damage in macromolecular crystallography: what is it and why should we care?». Acta Crystallographica D (en inglés) 66: 339-351. doi:10.1107/S0907444910008656.
- ↑ Garman, Elspeth F. (2003). «'Cool' crystals: macromolecular cryocrystallography and radiation damage». Current Opinion in Structural Biology 13 (5): 545-551. PMID 14568608. doi:10.1016/j.sbi.2003.09.013.
Bibliografía
- Brindley, G. y Brown, G. "Crystal structures of clay minerals and their X-Ray identification", Mineralogical Society, London (1980).
- Drenth, Jan (1999). Principles of protein x-ray crystallography (en inglés) (2ª edición). Springer. ISBN 9780387985879.
- Helliwell, John R. (1992). Macromolecular Crystallography with Synchrotron Radiation (en inglés). Cambridge University Press. ISBN 0-521-33467-5.
- Luger, Peter (1980). Modern x-ray analysis on single crystals (en inglés). Walter de Gruyter. ISBN 3-11-006830-3.
- Stout, George H.; Jensen, Lyle H. (1989). X-ray structure determination — A practical guide (en inglés) (2ª edición). John Wiley & sons. ISBN 0-471-60711-8.





























































































