Abstracción nucleofílica
La abstracción nucleofílica o abstracción nucleófila es un tipo de reacción organometálica que se puede definir como un ataque nucleófilo sobre un ligando de un complejo metálico que hace que parte o la totalidad del ligando original sea retirado del metal quedando secuestrado por el nucleófilo.[1][2]
Abstracción alquílica[editar]
Aunque la abstracción nucleófila de un grupo alquilo es relativamente poco común, hay ejemplos de este tipo de reacción. Para que esta reacción sea favorable, el metal debe primero ser oxidado, porque los metales reducidos son a menudo malos grupos salientes. La oxidación del metal hace que el enlace M-C se debilite, lo que permite que se produzca la abstracción nucleofílica. Un oxidante que se describe en la bibliografía es el I2 Y Br2.[3]
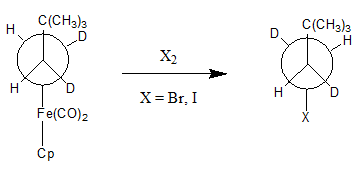
Es importante tener en cuenta que el producto de esta reacción se invierte con respecto al centro de la estereoquímica unido al metal.
Abstracción carbonílica[editar]
El N-óxido de trimetilamina (Me3NO) se puede utilizar en la abstracción nucleófila de carbonilo. Se produce un ataque nucleofílico en el carbono del grupo carbonilo por parte del Me3NO que empuja a los electrones en el metal. La reacción produce CO2 y NMe3.[4][5]

Abstracción de hidrógeno[editar]
La abstracción nucleofílica puede ocurrir en una parte del ligando de un metal si las condiciones son las adecuadas. Por ejemplo, en el siguiente ejemplo se muestra la abstracción nucleofílica de H+ de un ligando areno unido al cromo. La naturaleza electroatractora (que retira densidad electrónica) del cromo permite la reacción se produzca de una manera fácil.[1]
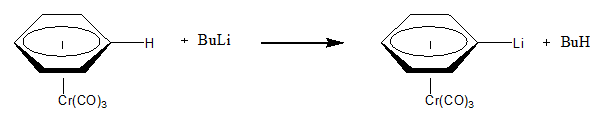
Abstracción metílica[editar]
Un carbeno de Fischer puede someterse a la abstracción nucleofílica donde se elimina un grupo metilo con la adición de un pequeño agente de abstracción, que ataca al carbono del carbeno. En este caso sin embargo, el volumen estérico del agente de abstracción que se añade provoca la abstracción del grupo metilo. Si el grupo metilo se sustituye con acetato, la reacción se produce unas 70 veces más lenta, lo que es de esperar con un mecanismo de desplazamiento SN2.[6]

Referencias[editar]
- ↑ a b Spessard, Gary; Miessler, Gary (2010).Organometallic Chemistry: Second Edition. pp. 285-289 ISBN 978-0-19-533099-1
- ↑ Xu, Ruren; Pang, Wenqin; Huo, Qisheng (2011).Modern Inorganic Synthetic Chemistry. pp. 275-278 ISBN 978-0-444-53599-3
- ↑ G.M. Whitesides and D. J. Boschetto, J. Am. Chem. Soc., 1971, 93, 1529.
- ↑ K. Yang, S. G. Bott, and M. G. Richmond, Organometallics, 1994, 13, 3788.
- ↑ M. O. Albers and N. Coville, J. Coord. Chem. Rev., 1984, 53, 227.
- ↑ L. M. Toomey and J. D. Atwood, Organometallics, 1997, 16, 490.
