Autoionización del agua

La autoionización del agua (también llamada autodisociación del agua) es la reacción química en la que dos moléculas de agua reaccionan para producir un ion hidronio (H3O+) y un ion hidróxido (OH−):
Este es un ejemplo de autoprotólisis, y se basa en la naturaleza anfotérica del agua.
El agua, aunque sea pura, no es una simple colección de moléculas de H2O. Incluso en "agua pura", un equipo sensible puede detectar una conductividad muy leve de 0,055 μS · cm-1. Según las teorías de Arrhenius, esto se debe a la presencia de iones.
Concentración y frecuencia[editar]
La anterior reacción tiene una constante de equilibrio químico de:
Así la constante de acidez es:[1]
Para reacciones en agua (o en soluciones acuosas diluidas), la molaridad (una unidad de concentración) del agua, [H2O], es prácticamente constante y se omite por convenio de la expresión de la constante de acidez. La constante de equilibrio que resulta se denomina constante de ionización, constante de disociación, constante de autoionización, o producto iónico del agua y se simboliza por Kw (se utiliza ''w'' para describir esta constante por su nombre en inglés, water)
donde:
En condiciones estándar de presión y temperatura, alrededor de 25 °C (298 K):
- .
El agua pura se ioniza o disocia en cantidades iguales de H3O+ y OH−, por lo que sus molaridades son iguales:
En condiciones estándar las concentraciones de hidróxido y oxonio son ambas tan bajas como 1,0 . 10−7 mol/L y los iones rara vez se producen: una molécula de agua seleccionada al azar se disocia aproximadamente cada 10 horas.[2] Puesto que la concentración de moléculas de agua en el agua está en su mayor parte sin afectar por la disociación y [H2O] es aproximadamente de 56 mol/L, se deduce que por cada 5,6 . 108 moléculas de agua, existirá un par de moléculas como iones. Cualquier solución en la que las concentraciones de H3O+ y OH− sean iguales se considera una solución neutra. El agua totalmente pura es neutra, aunque incluso pequeñas cantidades de impurezas pueden afectar a estas concentraciones de iones y el agua ya no sería neutra. Kw es sensible a la presión y la temperatura, aumentando cuando alguno de ellos aumenta.
Cabe señalar que el agua desionizada es el agua del grifo o de fuentes naturales a la que se le han quitado la mayoría de iones impureza (como Na+ y Cl-) por medio de la destilación o algún otro método de purificación de agua. La eliminación de todos, los iones del agua es casi imposible, ya que el agua se autoioniza para alcanzar el equilibrio.
Dependencia de la presión y la temperatura[editar]
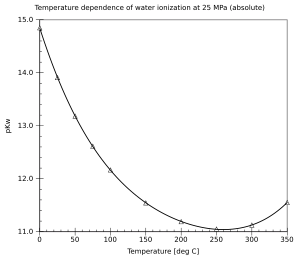
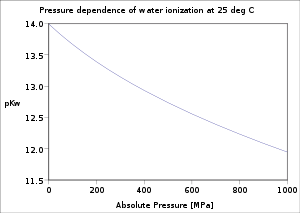
Por definición, . En condiciones normales, . El valor de pKw varía con la temperatura. Cuando aumenta la temperatura, pKw disminuye; y cuando la temperatura disminuye, pKw aumenta (para temperaturas por encima o alrededor de 250 °C). Esto significa que la autoionización del agua generalmente aumenta con la temperatura.
También hay una (generalmente pequeña) dependencia de la presión (aumenta cuando se aumenta la presión). La dependencia de la ionización del agua de la temperatura y la presión ha sido bien investigada y existe una formulación estándar.[3]
Acidez[editar]
El pH es una medida logarítmica de la acidez (o alcalinidad) de una solución acuosa. Por definición,
- pH = −log10 [H3O+].
Dado que [H3O+] = [OH−] en una solución neutra, matemáticamente se deduce que, para una solución neutra el pH = 7 (en condiciones normales).
La autoionización es el proceso que determina el pH del agua. Dado que la concentración de ion oxonio en CNPT, es aproximadamente 1,0·10−7 mol/L, el pH del agua líquida pura a esta temperatura es 7. Dado que Kw aumenta cuando lo hace la temperatura, el agua caliente tiene una mayor concentración de iones oxonio que el agua fría, pero esto no significa que sea más ácida, ya que la concentración de hidróxido es también superior en la misma cantidad.
Mecanismo[editar]
Geissler et al. Han determinado que las fluctuaciones del campo eléctrico en el agua líquida causa la disociación molecular.[4] Ellos proponen la siguiente secuencia de acontecimientos que tiene lugar en alrededor de 150 fs: el sistema comienza en un estado neutro, las fluctuaciones aleatorias en los movimientos moleculares de vez en cuando (alrededor de una vez cada 10 horas por la molécula de agua) producen un fuerte campo eléctrico lo suficientemente fuerte como para romper un enlace oxígeno-hidrógeno, dando como resultado un anión hidróxido (OH-) y un catión oxonio (H3O+); el protón del ion oxonio se desplaza a través de las moléculas de agua por el mecanismo de Grotthuss, y un cambio en la red de enlaces de hidrógeno en el disolvente aísla a los dos iones, que se estabilizan por solvatación.
En menos de 1 ps, sin embargo, una segunda reorganización de la red de enlaces de hidrógeno permite la rápida transferencia del protón gracias a la diferencia de potencial eléctrico y dando lugar a la posterior recombinación de los iones. Este período es coherente con el tiempo necesario para que los enlaces de hidrógeno se reorienten por sí mismos en el agua.[5][6][7]
Efectos isotópicos[editar]
El agua pesada, D2O, se autoioniza menos que el agua normal, H2O; el oxígeno forma un enlace ligeramente más fuerte con el deuterio porque la mayor masa del deuterio da como resultado una menor energía del punto cero, un efecto mecanocuántico. La tabla siguiente compara los valores de pKw para el H2O y el D2O.[8]
T (°C) pKw H2O D2O 10 14.5346 15.439 20 14.1669 15.049 25 13.9965 14.869 30 13.8330 14.699 40 13.5348 14.385 50 13.2617 14.103
Véase también[editar]
Referencias[editar]
- ↑ McMurry, John. (2004) Organic Chemistry, pg 44
- ↑ Eigen, M.; de Maeyer, L. (1955). «Untersuchungen über die Kinetik der Neutralisation I». Z. Elektrochem. 59: 986.
- ↑ International Association for the Properties of Water and Steam (IAPWS)
- ↑ Geissler, P. L.; Dellago, C.; Chandler, D.; Hutter, J.; Parrinello, M. (2001). «Autoionization in liquid water». Science 291: 2121-2124. PMID 11251111. doi:10.1126/science.1056991.
- ↑ Stillinger, F. H. (1975). «Theory and Molecular Models for Water». Adv. Chem. Phys. 31: 1. doi:10.1002/9780470143834.ch1.
- ↑ Rapaport, D. C. (1983). «Hydrogen bonds in water». Mol. Phys. 50: 1151. doi:10.1080/00268978300102931.
- ↑ Chen, S.-H. & Teixeira, J. (1986). «Structure and Dynamics of Low-Temperature Water as Studied by Scattering Techniques». Adv. Chem. Phys 64: 1. doi:10.1002/9780470142882.ch1.
- ↑ Lide, D. R. (Ed.) (1990). CRC Handbook of Chemistry and Physics (70th Edn.). Boca Raton (FL):CRC Press.
- Esta obra contiene una traducción derivada de «self-ionization of water» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
Enlaces externos[editar]
- General Chemistry—Autoionization of Water
- [1] Calculation of Ionic Product of Water by IAPWS ([2]) Formulations


![{\displaystyle K_{eq}={\dfrac {[H_{3}O^{+}]\cdot [OH^{-}]}{[H_{2}O]^{2}}}=3.23\cdot 10^{-18}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/d6153edacad6bcd7a51e63030953f3e25c593981)
![{\displaystyle K_{a}=K_{eq}\cdot [H_{2}O]={\dfrac {[H_{3}O^{+}][OH^{-}]}{[H_{2}O]}}=1.8\cdot 10^{-16}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/024879f047ef43f08c3ac12aa38399fa149f76bc)
![{\displaystyle K_{w}=K_{a}.[H_{2}O]=K_{eq}\cdot [H_{2}O]^{2}=[H_{3}O^{+}]\cdot [OH^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/395ade6a638a0dcb92517634f31c53c706b0f2cd)
![{\displaystyle K_{w}=[H_{3}O^{+}]\cdot [OH^{-}]=1.0\cdot 10^{-14}}](https://wikimedia.org/api/rest_v1/media/math/render/svg/b1c482e6cb4c2585088caebf195f46eb64f4f3a2)
![{\displaystyle [H_{3}O^{+}]=[OH^{-}]}](https://wikimedia.org/api/rest_v1/media/math/render/svg/7fd94b6b3c60067fcd15457db8ee563c2ed63b22)

