Bromoacetona
| Bromoacetona | ||
|---|---|---|
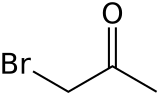 Estructura química | ||
 Estructura 3D | ||
| Nombre IUPAC | ||
| 1-Bromoacetona | ||
| General | ||
| Otros nombres | 1-Bromo-2-propanona; α-Bromoacetona; Monobromoacetona | |
| Fórmula molecular | CH3COCH2Br | |
| Identificadores | ||
| Número CAS | 598-31-2[1] | |
| Número RTECS | UC0525000 | |
| ChEBI | 51845 | |
| ChEMBL | CHEMBL1085947 | |
| Propiedades físicas | ||
| Apariencia | Líquido incoloro | |
| Punto de fusión | −36,5 °C (237 K) | |
| Punto de ebullición | 137 °C (410 K) | |
| Presión de vapor | 1.1 kPa (20 °C) | |
| Peligrosidad | ||
| SGA |
  | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
La bromoacetona es un compuesto orgánico con la fórmula CH3COCH2Br. Este líquido incoloro es un agente lacrimógeno, precursor de otros compuestos orgánicos.
Origen[editar]
Es una sustancia presente de forma natural (menos de 1%) en el aceite esencial de un alga que se encuentra en las proximidades de las islas Hawái.[2]
Síntesis[editar]
Está disponible comercialmente, en ocasiones estabilizada con óxido de magnesio. Fue descripta por primera vez en el siglo XIX, trabajo que se le atribuye a N. Sokolowsky.[3]

La bromacetona se prepara mediante la combinación de bromo y acetona,[4] con un ácido catalítico. Si se utiliza una base, el producto obtenido será bromoformo:
- CH3C (O) CH3 + Br2 → CH3C (O) CH2Br + HBr
La principal dificultad con este método es el exceso de bromación, que resulta en productos di y tribrominados. En términos de mecanismo, como con todas las cetonas, la acetona se enoliza en presencia de ácidos o bases. El carbono alfa a continuación, se somete a sustitución electrófila con bromo.[5]
Aplicaciones[editar]
Fue utilizada en la Primera Guerra Mundial como arma química, llamada BA por británicos y B-Stoff (cruz blanca) por los alemanes. Debido a su toxicidad, es obsoleta como un agente de control de disturbios y ya no se utiliza. Es además un reactivo versátil en la síntesis orgánica, por ejemplo como precursor en la reacción de producción de hidroxiacetona (N º CAS 116-09-6).[6]
Véase también[editar]
Referencias[editar]
- ↑ Número CAS
- ↑ Burreson, B. J.; Moore, R. E.; Roller, P. P. (1976). «Volatile halogen compounds in the alga Asparagopsis taxiformis (Rhodophyta)». Journal of Agricultural and Food Chemistry 24 (4): 856-861. doi:10.1021/jf60206a040.
- ↑ Wagner, G. (1876). «Sitzung der russischen chemischen Gesellschaft am 7./19. October 1876». Berichte der Deutschen Chemischen Gesellschaft 9 (2): 1687-1688. doi:10.1002/cber.187600902196.
- ↑ Levene, P. A. (1930). "Bromoacetone". Org. Synth. 10: 12; Coll. Vol. 2: 88.
- ↑ Reusch, W. (5 de mayo de 2013). «Carbonyl Reactivity». Virtual Textbook of Organic Chemistry. Michigan State University. Archivado desde el original el 21 de junio de 2010. Consultado el 4 de julio de 2014.
- ↑ Levene, P. A.; Walti, A. (1930). "Acetol". Org. Synth. 10: 1; Coll. Vol. 2: 5.
Enlaces externos[editar]
- Esta obra contiene una traducción parcial derivada de «Bromoacetone» de Wikipedia en inglés, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
