Cruce intersistema

Un cruce intersistema (CIS) es un proceso no radiativo que implica la transición entre dos estados electrónicos con diferente multiplicidad de espín.[1]
Estados singlete y triplete[editar]
Cuando se excita a un electrón en una molécula en un estado basal singlete (ya sea por absorción o radiación) hacia un estado de mayor energía, se puede obtener un estado excitado singlete o triplete.
Se denomina estado singlete a un estado electrónico en el cual todos los espínes electrónicos se encuentran apareados. Esto significa que el espín del electrón excitado aún se encuentra apareado con otro electrón en estado basal (un par de electrones con la misma energía deben tener espines opuestos, según indica el principio de exclusión de Pauli. En un estado triplete el electrón excitado ya no se encuentra apareado con el electrón en estado basal; esto significa que ahora poseen los mismos espines paralelos. Ya que la excitación a un nivel triplete implica una transición de espín "prohibida", es menos probable que se forme un estado triplete cuando la molécula absorbe radiación.
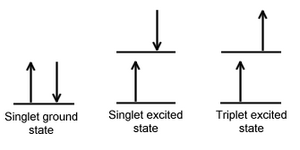
Cruce intersistema[editar]
Cuando un estado singlete pasa en forma no radiativa a un estado triplete, o a la inversa, de un estado triplete a un singlete, este proceso se denomina cruce intersistema. En esencia, el espín del electrón excitado se invierte. La probabilidad de que ocurra este proceso es más probable cuando los niveles vibracionales de dos estados excitados se solapan, ya que de esta forma se produce una ganancia o pérdida de energía muy pequeña, o directamente nula, durante la transición. Ya que las interacciones espín/orbital son sustanciales y un cambio en el espín es menos favorable, los cruces intersistema son más comunes en moléculas con átomos pesados (por ejemplo en aquellas que contienen yodo o bromo). Este proceso se denomina acoplamiento espín-órbita. En pocas palabras, implica el acoplamiento del espín electrónico con el momento angular orbital de las órbitas no circulares. Adicionalmente, la presencia de especies paramagnéticas en la solución potencian los cruces intersistema.[2]
Fosforescencia[editar]
El decaimiento radiativo desde un estado excitado triplete a un estado basal singlete se denomina fosforescencia. Ya que se produce una transición entre multiplicidades de espín, la fosforescencia es una manifestación del cruce intersistema. La escala de tiempo de los cruces intersistema se encuentra en el orden de los 10−8 a los 10−3 segundos, por lo que se trata de una de las formas más lentas de relajación.[3]
Referencias[editar]
- ↑ Unión Internacional de Química Pura y Aplicada. «Intersystem crossing». Compendium of Chemical Terminology. Versión en línea (en inglés).
- ↑ Douglas A. Skoog, F. James Holler, and Timothy A. Nieman. Principles of Instrumental Analysis, 5th Ed. Brooks/Cole, 1998.
- ↑ Donald A. McQuarrie and John D. Simon. Physical Chemistry, a Molecular Approach. University Science Books, 1997.
