Glossina morsitans morsitans

Glossina morsitans morsitans es una subespecie de Glossina morsitans. Pertenece al grupo de moscas de la sabana conocidas como moscas tsetse, que son vectores de los parásitos causantes de la enfermedad del sueño o tripanosomiasis africana.
La mosca tsetse Glossina morsitans morsitans es el vector de transmisión del Trypanosoma brucei rhodesiense, un protozoo flagelado y parásito que produce la enfermedad del sueño o tripanosomiasis africana. Esta infección tiene graves consecuencias sanitarias y económicas ya que afecta tanto a las personas como a los animales. Es por ello que el estudio de Glossina morsitans morsitans se considera clave para el desarrollo de medidas de control para este díptero, que a su vez supongan un mayor control de la enfermedad, puesto que se estima que 70 millones de personas están en riesgo de infección.[International Glossina Genome Initiative 1]
Clasificación taxonómica[editar]
Eukaryota/ Opisthokonta/ Metazoa/ Eumetazoa/ Bilateria/ Protostomia/ Ecdysozoa/ Panarthropoda/ Arthropoda/ Mandibulata/ Pancrustacea/ Hexapoda/ Insecta/ Dicondylia/ Pterygota/ Neoptera/ Endopterygota/ Diptera/ Brachycera/ Hippoboscoidea/ Glossinidae/ Glossina/ Glossina/ Glossina morsitans.[1]
Descripción[editar]
G. m. morsitans se engloba en el grupo de moscas de la sabana, ya que son xerófilas, es decir, habitan en ambientes extremadamente secos. Mide aproximadamente 15 mm de longitud. Ambos sexos son hematófagos. En cuanto a su ciclo biológico son vivíparos adenotrofos. En condiciones ambientales y de alimentación óptimas las hembras pueden vivir hasta 6 meses y los machos entre 3 y 4 meses. La proporción de moscas infectadas no suele superar el 2-3% de la población, la prevalencia es baja.[2][3][4][5]
Área de distribución[editar]
G. m. morsitans se distribuye de forma focal en la zona tropical africana o África Subsahariana, determinando a su vez el área de distribución de las especies de Trypanosoma responsables de la enfermedad del sueño en el ser humano y de nanaga en animales.
Glossina morsitans es endémica de 37 países de esta zona, pero a fecha de 2017 aun se desconoce su distribución completa, la cual podría sufrir modificaciones como consecuencia del cambio climático.[6]

Genoma de Glossina[editar]
En 2004 se constituyó la Iniciativa Internacional del Genoma de Glossina (International Glossina Genome Initiative) con el fin de promover la investigación sobre los genomas de las diferentes especies de Glossina.
El genoma de G. m. morsitans tiene un tamaño de 366 Mb, más del doble que el de Drosophila melanogaster. Ambas especies muestran regiones sinténicas, lo que refleja su relación filogenética, aunque la longitud de estas secuencias es más larga en G. m. morsitans, se cree que debido a un mayor tamaño de los intrones y de las regiones intergénicas por actividad de transposones y/o expansión de secuencias repetidas. El 14% del genoma de G. m. morsitans son secuencias de los grupos mayoritarios de retrotransposones y transposones de ADN. Codifica para unas 12 308 proteínas y el tamaño de sus genes es el doble que el tamaño de los genes de Drosophila.[7][2]
Alimentación[editar]
Las moscas, de ambos sexos, del género Glossina son hematófagas, pero a diferencia de otros animales hematófagos, Glossina utiliza la sangre ingerida como única fuente de energía y nutrientes. Por tanto, se alimentan succionando la sangre de diferentes animales: sobre todo de mamíferos, pero también, aunque en menor medida, de reptiles y aves. Por tanto, se alimentan de varios tipos de animales pero muestran preferencias.
Produce unas 250 moléculas salivales, que van a contrarrestar las respuestas fisiológicas del hospedador ante su picadura (coagulación, agregación plaquetaria, vasoconstricción). Son fundamentales para una alimentación y una digestión eficaces. En su sialoma (conjunto de ARNm y de proteínas que se expresan en las glándulas salivales) se han encontrado diferentes familias de genes que codifican para dichas moléculas salivales:
- Genes tsal: Poseen 3 genes de esta familia. Codifican para proteínas endonucleasas.
- Familia de genes ADGF (factores de crecimiento relacionados con la adenosina desaminasa): Poseen 4 genes AGDF, relacionados con codificación de proteínas que va a reducir la inflamación en el hospedador tras la laceración producida por su picadura y la posterior inoculación de sangre.
La cantidad de sangre que ingiere Glossina es equivalente a su propio peso. Se alimentan cada 2-3 días, pudiendo resistir hasta 10 días si las condiciones ambientales no son favorables (frías y húmedas). El exceso de agua lo excreta de forma rápida y eficaz a través de acuoporinas. Poseen 10 genes aqps que codifican para estas acuoporinas.
Si una mosca tsetse ingiere sangre de un animal infectado con tripanosomas, la mosca ingiere junto con la sangre los tripanosomas pudiendo así infectarse ella también. Si finalmente la mosca resulta infectada, la expresión de algunos de los genes de la mosca se ve afectada, por ejemplo, como los tripanosomas causan daño mecánico en las células de las glándulas salivales se ve aumenta la expresión de genes relacionados con la reparación celular. Se ha visto que hay además un aumento en los genes implicados en la tolerancia al estrés, lo que favorece la infección.
Como consecuencia de su dieta tan restringida, solo sangre, posee un metabolismo adaptado a la misma. De este modo, tiene reducido el metabolismo de los hidratos de carbono, carece de genes relacionados con la percepción del sabor dulce. En cambio, sí tiene genes muy conservados en relación al metabolismo de los lípidos así como genes que codifican para tres transportadores de multivitaminas.[2][8][9]
Microbioma[editar]
G. m. morsitans es portadora de multitud de microorganismos simbiontes, mutualistas y parásitos. Simbiontes y mutualistas son transmitidos vía materna. Además, se han observado transferencias horizontales de genes entre estos microorganismos y G. m. morsitans.
- Wigglesworthia glossinidia: Es una bacteria simbionte obligado de Glossina morsitans. Habita tanto intracelularmente en las células del intestino medio como extracelularmente en el lumen de las glándulas de la leche. Está implicada en la nutrición de las larvas ya que biosintetiza vitamina B y tiamina fosfato (Glossina morsitans no puede) supliendo las necesidades nutricionales derivadas de la estricta dieta de esta mosca. También es determinante en la estimulación del desarrollo de su inmunidad. Wigglesworthia ha coevolucionado con las moscas tsetse. En su ausencia, Glossina morsitans morsitans tiene abortos prematuros[2] y, además, su sistema inmune adulto se ve comprometido.[2]
- Sodalis glossinidius: microorganismo bacteriano comensal que va a debilitar la estructura de la matriz peritrófica mediante la secreción de chitinasas, lo que facilita la infección por otros parásitos como los tripanosomas. La simbiosis con Sodalis favorece la infección por tripanosomas, es tres veces más probable que las moscas que establezcan simbiosis con Sodalis sean infectadas por tripanosomas .[5]
- Wolbachia pipientis: origina infecciones facultativas, las cuales influyen en la fisiología del hospedador.
- Hytrosavirus: Parásito que disminuyen la fertilidad y la esperanza de vida de Glossina[2][4][5][10][11][12][13][14]
En cuanto a su flora intestinal habitual los géneros con mayor representación son Enterobacter, Enterococcus y Acinetobacter. Es sorprendente, a pesar de su dieta basada solo en la ingesta de sangre, el hecho de que haya tanta variedad de microorganismos formando parte de su microbiota.[5]
Inmunidad[editar]
La edad, el sexo, el estado nutricional y las relaciones simbióticas influyen en que una Glossina pueda ser vector o no de tripanosomas. La prevalencia de Glossina morsitans mortsitans infectadas por tripanosomas es mínima, esta mosca presenta una fuerte respuesta inmune frente a dicha infección. El mecanismo exacto de esta respuesta inmune no se conoce todavía por completo, pero se han identificado genes para dominios CLIP de serin proteasas y para sus inhibidores (serpin) muy conservados evolutivamente.[15]
En su inmunidad son determinantes las relaciones simbióticas. En ausencia de Wigglesworthia glossinidia, durante el desarrollo larvario intrauterino de Glossina morsitans morsitans, se ha visto que el sistema inmune de esas moscas está comprometido.[2]
En comparación con Drosophila melanogaster, Glossina morsitans morsitans posee menos genes pgrp que codifican para proteínas de reconocimiento de peptidoglicanos (PGRPs), lo que implica una disminución de su respuesta inmmune para así poder proteger su simbiosis obligada con Wigglesworthia. Esta disminución en el número de genes pgrp también se debe a su alimentación tan restringida, ya que Glossina morsitans morsitans expone su aparato digestivo a una menor cantidad de microorganismos que Drosophila.[2]
Reproducción y desarrollo biológico[editar]
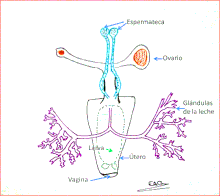
Las Glossina son vivíparos adenotrofos (el desarrollo del huevo se completa en el interior del cuerpo de la hembra, con lo que no pone huevos sino que directamente pare larvas), por ello presenta adaptaciones morfológicas como reducción del folículo ovárico, expansión y adaptación del útero para el desarrollo larvario y adaptación de las glándulas accesorias para sintetizar nutrientes y su posterior liberación. La hembra es fecundada solo una vez en su vida y pare una larva cada 10 días, es decir, desarrolla un oocito en cada ciclo, hasta una decena de larvas. La larva es blanca, grande (1 cm) y corpulenta. Una vez depositada en el suelo por la hembra se entierra y se transforma en pupa, de donde emerge el adulto a los 30-60 días según la especie de Glossina.[2][16][17]
Glossina, debido a su tipo de reproducción, ha perdido evolutivamente los genes que codifican para las proteínas nutritivas presentes en los huevos, así solo posee un gen, el gen yp (yolk protein.[2]
Las larvas de Glossina dependen para su desarrollo tanto de la leche secretada por la madre en las glándulas especializadas para ello, como de las relaciones simbióticas.
Las glándulas de la leche están muy especializadas, secretan una mezcla compleja de lípidos, proteínas y agua. Se han identificado 12 genes implicados en la síntesis de la leche, los cuales están sujetos a una regulación transcripcional muy intensa y se ven implicados en la emulsión de lípidos, también en el aporte de aminoácidos para la síntesis de proteínas y en el transporte de fosfatos.
La leche es almacenada en vacuolas, a continuación se secreta al lumen donde se encuentra el simbionte Wigglesworthia. para después ser transportados ambos (leche y simbionte) al útero, donde las larvas en desarrollo se alimentarán de estas secreciones.
Durante la lactancia y tras el parto se generan altos niveles de estrés oxidativo, es por ello que Glossina ha potenciado la expresión de enzimas antioxidantes en estas dos etapas. Se han identificados genes AOE que codifican para estas enzimas antioxidantes, son muy importantes para preservar la fecundidad posterior de estas moscas.
Las proteínas de la leche de Glossina son funcionalmente muy parecidas a las de la leche de los mamíferos.
Es un proceso cíclico.[2][16][17]
Estrategias de control a través de los sentidos[editar]
Estas moscas van a elaborar diferentes respuestas químicas y visuales tanto para encontrar alimento como para encontrar pareja. Su sistema visual está muy conservado tanto morfológicamente como funcionalmente. Su visión es rápida para identificar, localizar y perseguir a los animales de los que obtendrá su alimento.
Glossina se ve muy atraída por el color azul, lo que es muy utilizado en la elaboración de trampas.[2][16]
- ↑ «Genome sequence of the Tsetse Fly (Glossina morsitans): Vector of African trypanosomiasis». Science: 380-386. 2014. doi:10.1126/science.1249656.
Referencias[editar]
- ↑ «Glossina morsitans morsitans». diArk | species_list. Consultado el 12 de febrero de 2017.
- ↑ a b c d e f g h i j k l «Genome sequence of the tsetse Fly (Glossina morisitans): Vector of African Trypanosomiasis». Science. 2014. doi:10.1126/science.1249656.
- ↑ Holmes, Peter (2013). «Tsetse-transmitted trypanosomes- Their biology, disease impact and control». Journal of Invertebrate Pathology. doi:10.1016/j.jip.2012.07.014.
- ↑ a b Doudoumis, Vangelis (2013). «Tsetse-Wolbachia symbiosis: Comes of age and has great potential for pest and disease control». Journal of Invertebrate Pathology 112: S94-S103.
- ↑ a b c d Soumana Hamidou, Illiassou (S89-S93). «The bacterial flora f tsetse fly midgut ans its effect on trypanosome transmission». Journal of Invertebrate Pathology 112. Supplement 1.
- ↑ «distribución de Glossina morsitans». vectorbase.org. Consultado el 15 de febrero de 2017.
- ↑ Aksoy. S (2003). «Control of tsetse flies and trypanosomes using molecular genetics». Vet Parasitol.: 125-145. PMID 12878419.
- ↑ Farikou, Oumarou (2010). «Tsetse fly blood meal modification and trypanosome identification in two sleeping sickness foci in the forest of southern Cameroon». Acta tropica: 81-88.
- ↑ Bai, Xuewei (2015). «An immunoregulatory peptide from tsetse fly salivary glands of Glossina morsitans morsitans». Biochimie 118: 123-128.
- ↑ Aksoy, S; Rio RV. (2008). «Interactions among multiple genomes: tsetse, its symbionts and trypanosomes.». Insect Biochem Mol Biol. doi:10.1016/j.ibmb.2005.02.012.
- ↑ Farikou, O.; Njiokou (2010). «Tripartite interactions between tsetse flies, Sodalis glossinidius and trypanosomes--an epidemiological approach in two histrical human African trypanosomiasis foci in Cameroon». Infect Genet Evol (10): 115-121. doi:10.1016/j.meegid.2009.10.008.
- ↑ Farikou, Oumarou; Njiokou, Flobert (2011). «Microsatellite genotyping reveals diversity within populations of Sodalis glossinidius, the secondary symbiont of tsetse flies». Veterinary Microbiology 150: 207-210.
- ↑ Gosalbes, María José; Latorre, Amparo (2010). «Genomics of intracellular symbionts in insects». International Journal of Medical Microbiology 300: 271-278.
- ↑ Mbewe. J., Njelembo (2015). «Microbiome frequency and their association with trypanosome infection in male Glossina morsitans centralis of Western Zambia». Veterinary Parasitology 211: 93-98.
- ↑ Mwangi, Sarah; Murungi, Edwin (2011). «Evolutionary genomics of Glossina morsitans immune-related CLIP domain serine proteases and serine protease inhibitors». Infection, Genetics and Evolution 11: 740-745.
- ↑ a b c Service, Mike (2008). «9: Tse-tse flies. Glossinidae». Medical Entomology for Students (4 edición). Cambridge University Press. p. 121-134.
- ↑ a b Attardo. M, Geoffrey; Benoit. B., Joshua (2012). «Analysis of lipolysis underlying lactation in the tsetse fly, Glossina morsitans». Insect Biochemistry and Molecular Biology 42: 360-370.
