Inseminación traumática

La inseminación traumática, también conocida como inseminación hipodérmica, es la práctica de apareamiento en algunas especies de Invertebrados en la que el macho perfora el abdomen de la hembra con su edeago e inyecta su esperma a través de la herida en su cavidad abdominal (hemocoel).[1] El esperma se difunde a través de la hemolinfa de la hembra, alcanzando los ovarios y dando como resultado la fertilización.
El proceso es perjudicial para la salud de la hembra. Crea una herida abierta que perjudica a la hembra hasta que sana y es susceptible a la infección. La inyección de esperma y fluidos eyaculatorios en el hemocoel también puede desencadenar una reacción inmunitaria en la hembra. Las chinches, que se reproducen únicamente por inseminación traumática, han desarrollado un par de receptáculos de esperma, conocidos como espermalegio. Se ha sugerido que el espermalegio reduce el daño directo a la chinche hembra durante la inseminación traumática. Sin embargo, los experimentos no encontraron evidencia concluyente para esa hipótesis; a partir de 2003, la explicación preferida para ese órgano es la protección higiénica contra las bacterias.[2]
Se discuten los orígenes evolutivos de la inseminación traumática. Aunque evolucionó de forma independiente en muchas especies de invertebrados, la inseminación traumática está más adaptada y estudiada a fondo en las chinches, en particular Cimex lectularius.[1][3] La inseminación traumática no se limita a las parejas macho-hembra, ni siquiera a las parejas de la misma especie. Se han observado inseminaciones traumáticas tanto homosexuales como entre especies.
Mecánica[editar]

En los humanos y otros vertebrados, la sangre y la linfa circulan en dos sistemas diferentes, el sistema circulatorio y el sistema linfático, que están encerrados por sistemas de capilares, venas, arterias y ganglios. Esto se conoce como un sistema circulatorio cerrado. Los insectos, sin embargo, tienen un sistema circulatorio abierto en el que la sangre y la linfa circulan sin cerrarse y se mezclan para formar una sustancia llamada hemolinfa. Todos los órganos del insecto están bañados en hemolinfa, que proporciona oxígeno y nutrientes a todos los órganos del insecto.[4]
Luego de una inseminación traumática, los espermatozoides pueden migrar a través de la hemolinfa hacia los ovarios de la hembra, lo que resulta en la fertilización. La mecánica exacta varía de un taxón a otro. En algunos órdenes de insectos, los genitales masculinos (parámero) ingresan al tracto genital de la hembra, y una espina en su punta perfora la pared de la bursa copulatrix de la hembra. En otros, el macho penetra la pared exterior del cuerpo. En cualquier caso, después de la penetración, el macho eyacula en la hembra. El esperma y los fluidos eyaculatorios se difunden a través de la hemolinfa de la hembra. La inseminación tiene éxito si los espermatozoides llegan a los ovarios y fecundan un óvulo.[1]
La resistencia de las hembras a la inseminación traumática varía de una especie a otra. Las hembras de algunos géneros, incluido Cimex, son pasivas antes y durante la inseminación traumática.[5] Las hembras de otros géneros resisten el apareamiento e intentan escapar.[6] Esta resistencia puede no ser una aversión al dolor causada por la inseminación, ya que la evidencia observacional sugiere que los insectos no sienten dolor.[7]
La investigación sobre la paternidad de la descendencia producida por inseminación traumática ha encontrado una precedencia "significativa" del último espermatozoide. Es decir, el último macho en inseminar traumáticamente a una hembra tiende a engendrar la mayor parte de la descendencia de esa hembra.[8]
Adaptación evolutiva[editar]
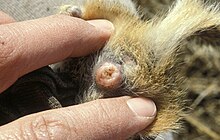
Se han sugerido muchas razones para la adaptación evolutiva de la inseminación traumática como estrategia de apareamiento. Una es que la inseminación traumática es una adaptación al desarrollo del tapón de apareamiento, un mecanismo reproductivo utilizado por muchas especies. Una vez que un macho termina de copular, inyecta una secreción glutinosa en el tracto reproductivo de la hembra, "pegando literalmente su tracto genital cerrado".[9] La inseminación traumática permite que los machos subsiguientes pasen por alto el tracto genital obstruido de la hembra e inyecten esperma directamente en su sistema circulatorio.
Otros han argumentado que la práctica de la inseminación traumática puede haber sido una adaptación de los machos para eludir la resistencia de las hembras al apareamiento[1] para eliminar el tiempo de cortejo, permitiendo que un macho insemine a muchas parejas cuando el contacto entre ellas es breve;[10] o que evolucionó como un nuevo desarrollo en la competencia de espermatozoides como un medio para depositar espermatozoides lo más cerca posible de los ovarios.
Este extraño método de inseminación probablemente evolucionó cuando los chinches macho compitieron entre sí para colocar su esperma cada vez más cerca de la veta madre de los óvulos, los ovarios. Algunos insectos machos desarrollaron penes largos con los que ingresan a la vagina pero evitan la bolsa de almacenamiento de la hembra y depositan su esperma río arriba cerca de los ovarios. Unos pocos machos, especialmente entre las chinches, desarrollaron una inseminación traumática y, finalmente, este extraño procedimiento se convirtió en la norma entre estos insectos.[11]
Recientemente se ha descubierto que miembros del género de chinches de las plantas Coridromius (Miridae) también practican la inseminación traumática. En estas chinches, el órgano intromitente masculino está formado por el acoplamiento del edeago con el parámero izquierdo, como en las chinches. Las hembras también exhiben modificaciones paragenitales en el sitio de la intromisión, que incluyen surcos y tubos copuladores invaginados para guiar el parámero masculino. La evolución de la inseminación traumática en Coridromius representa una tercera aparición independiente de esta forma de apareamiento dentro de los verdaderos bichos.[12]
Repercusiones en la salud[editar]
Si bien es ventajosa para el éxito reproductivo del macho individual, la inseminación traumática impone un costo a las hembras: reducción de la vida útil y disminución del rendimiento reproductivo. "Estos [costos] incluyen (i) la reparación de la herida, (ii) la fuga de sangre, (iii) el aumento del riesgo de infección a través de la herida punzante y (iv) la defensa inmunitaria contra los espermatozoides o los fluidos de las glándulas accesorias que se introducen directamente en la sangre."[1]
Se ha demostrado que el chinche macho aedeagus porta cinco microbios patógenos (humanos) y el exoesqueleto de las chinches hembra nueve, incluidos Penicillium chrysogenum, Staphylococcus saprophyticus, Stenotrophomonas maltophilia, Bacillus licheniformis y Micrococcus luteus. Las pruebas con agar sangre han demostrado que algunas de estas especies pueden sobrevivir in vivo. Esto sugiere que las infecciones de estas especies pueden contribuir al aumento de la tasa de mortalidad de las chinches debido a la inseminación traumática.[13]
Cada herida sucesiva requiere energía para sanar, dejando menos energía disponible para otras actividades. Además, las heridas proporcionan un posible punto de infección que puede reducir la vida útil de la hembra.[8] Una vez en la hemolinfa, los espermatozoides y los fluidos eyaculatorios pueden actuar como antígenos y desencadenar una reacción inmunitaria.
Hay una tendencia a que las colonias densas de chinches mantenidas en laboratorios se extingan, comenzando con las hembras adultas.[14] En tal ambiente, donde el apareamiento ocurre con frecuencia, esta alta tasa de mortalidad de hembras adultas sugiere que la inseminación traumática es muy perjudicial para la salud de la hembra.[1] Se ha demostrado que el daño causado y la (innecesariamente) alta tasa de apareamiento de las chinches cautivas causan una tasa de mortalidad un 25% superior a la necesaria para las hembras.[15]
Adaptación de chinches[editar]

Los efectos de la inseminación traumática son perjudiciales para la hembra. Las chinches hembra han desarrollado un par de órganos reproductivos especializados ("paragenitales") en el sitio de penetración. Conocidos como ectoespermalego y mesoespermalego (denominados colectivamente espermalego), estos órganos sirven como receptáculos de esperma desde los cuales los espermatozoides pueden migrar a los ovarios.[2][16] Toda la reproducción de chinches se produce a través de la inseminación traumática y el esperma. El tracto genital, aunque funcional,[17] se usa solo para poner huevos fertilizados.[3]
El ectoespermalego es una hinchazón en el abdomen, a menudo plegada, llena de hemocitos. El ectoespermalego es visible externamente en la mayoría de las especies de chinches, dando al macho un objetivo a través del cual empalar a la hembra con el parámero. En especies sin un ectoespermalego visible externamente, la inseminación traumática tiene lugar en una amplia gama de la superficie del cuerpo.[17]
No está claro exactamente por qué los machos 'cumplen' con este aspecto del control femenino sobre el sitio de apareamiento, especialmente porque el macho 'P. cavernis parece ser capaz de penetrar el abdomen en varios puntos independientemente de la presencia de un ectoespermalego. Una posibilidad es que el apareamiento fuera del ectoespermalego reduzca la fecundidad femenina hasta tal punto que la paternidad del macho que se aparea se reduzca significativamente ... El ectoespermalego parece actuar como una guía de apareamiento, dirigiendo el interés copulatorio del macho y, por lo tanto, el daño, a un área restringida del abdomen de la hembra.[17]
El mesoespermalego es un saco adherido al interior del abdomen, debajo del ectoespermalego. El esperma se inyecta a través del edeago del macho en el mesospermalego. En algunas especies, el ectoespermalego se conecta directamente a los ovarios; por lo tanto, los espermatozoides y la eyaculación nunca ingresan a la hemolinfa y, por lo tanto, nunca desencadenan una reacción inmune. (Las características exactas del espermalego varían ampliamente entre las diferentes especies de chinches.)[1] Los espermales generalmente se encuentran solo en las hembras. Sin embargo, los machos del género Afrocimex poseen un ectospermalegio.[1] El esperma permanece en el semen durante aproximadamente cuatro horas; después de dos días, no queda ninguno.[3]
Los chinches de cama machos han desarrollado quimiorreceptores en sus aedeagi. Después de empalar a una hembra, el macho puede "saborear" si una hembra se ha apareado recientemente. Si lo hace, no copulará tanto tiempo y eyaculará menos líquido en la hembra.[18]
Uso en el reino animal[editar]
Aunque la inseminación traumática se practica más ampliamente entre los heterópteros (insectos típicos), el fenómeno se ha observado en una amplia variedad de otros taxones de invertebrados. Éstas incluyen:
- Oxyurida (nematodos): se ha observado inseminación traumática en géneros de oxiuros, incluidos Auchenacantha, Citellina, Passalurus y "probablemente" Austroxyris.[1][19][20]
- Acanthocephala (gusanos parásitos de cabeza espinosa): la presencia de tapones de apareamiento en los costados de Pomphorhynchus bulbocolli sugiere que se produce una inseminación traumática en esta especie. Debido a que estos parásitos no pueden moverse después de anclarse al intestino del huésped, la inseminación traumática puede haber evolucionado para compensar su inmovilidad.[1][21]
- Rotifera (animálculos de rueda) – En el género Brachionus, el macho perfora el tegumento sincitial (equivalente a la piel) e inyecta esperma; en Asplanchna brightwelli, el macho secreta una enzima que descompone el tegumento femenino e inyecta esperma a través del orificio.[22][23]
- Turbellaria (gusanos planos de vida libre) – Los gusanos planos hermafroditas se reproducen por "esgrima del pene". Los individuos "cercan" con penes, intentando usar su pene para perforar la piel del otro e inyectar esperma. El 'perdedor' es el platelminto que es inseminado y debe asumir los costes energéticos de la reproducción. Un estudio de Pseudoceros bifurcus encontró que "la mayoría de las inseminaciones fueron unilaterales. Incluso cuando la segunda pareja pudo lograr la inserción recíproca del pene, el primero en inseminar obtuvo un tiempo de inyección más largo que el segundo".[24][25] En otra especie, Macrostomum hystrix, el gusano también puede inyectar su esperma en su propia cabeza si no hay otras parejas disponibles.[26]
- Caracoles gasterópodos[1]
- Strepsiptera (parásitos de alas retorcidas): en Xenos vesparum, la fertilización puede ocurrir a través de conductos extragenitales o por inseminación traumática en el hemocoel.[27]
- Drosophila (moscas de la fruta): los eyaculados se inyectan a través de la pared del cuerpo en el tracto genital, no en el abdomen.[28]
- Opisthobranchia (babosas de mar): se caracteriza por "pequeñas inyecciones repetidas en la superficie dorsal de la pareja, interrumpidas por movimientos circulares sincronizados", que culminan en una inseminación genital estándar.[29]
- Harpactea (arañas): el macho de la especie de araña Harpactea sadistica perfora la cavidad del cuerpo de la hembra e insemina sus ovarios directamente.[30]
Inseminación traumática homosexual[editar]
La inseminación traumática no se limita a las parejas macho-hembra. Se han observado inseminaciones traumáticas homosexuales masculinas en la chinche de las flores Xylocoris maculipennis[9] y chinches del género Afrocimex.[1]
En el género Afrocimex, ambas especies tienen un ectoespermalego bien desarrollado (pero solo las hembras tienen un mesoespermalego). El ectoespermalege masculino es ligeramente diferente del que se encuentra en las hembras y, sorprendentemente, Carayon (1966) descubrió que los machos de las chinches Afrocimex sufren inseminaciones traumáticas homosexuales reales. Descubrió que el ectoespermalege masculino a menudo mostraba cicatrices de apareamiento características, y los estudios histológicos mostraron que los espermatozoides "extraños" estaban ampliamente dispersos en los cuerpos de estos machos apareados homosexualmente. Sin embargo, nunca se encontraron espermatozoides de otros machos en o cerca del tracto reproductivo masculino. Por lo tanto, parece poco probable que el esperma de otros machos pueda ser inseminado cuando un macho que ha sufrido una inseminación traumática se aparea con una hembra. Se desconocen los costos y beneficios, si los hubiere, de la inseminación traumática homosexual en Afrocimex.[1]
Klaus Reinhardt de la Universidad de Sheffield y sus colegas observaron dos tipos morfológicamente diferentes de esperma en Afrocimex constrictus, una especie en la que tanto machos como hembras son inseminados traumáticamente. Descubrieron que las hembras usan la mímica sexual como una forma de evitar la inseminación traumática. En particular, observaron que los machos y las hembras que tenían estructuras de esperma masculino eran inseminados con menos frecuencia que las hembras con estructuras de esperma femenino.[31]
En Xylocoris maculipennis, después de que un macho insemina traumáticamente a otro macho, los espermatozoides inyectados migran a los testículos. (El fluido seminal y la mayor parte de los espermatozoides se digieren, dando al macho inseminado una comida rica en nutrientes.) Se ha sugerido, aunque no hay pruebas, que cuando el macho inseminado eyacula en una hembra, la hembra recibe el esperma de ambos machos.[32][33]
Inseminación traumática entre especies[editar]
Los casos de inseminación traumática entre animales de diferentes especies a veces provocarán una reacción inmune posiblemente letal. Una hembra de Cimex lectularius inseminada traumáticamente por un macho de C. hemipterus se hinchará en el lugar de la inseminación a medida que el sistema inmunitario responda a la eyaculación masculina. En el proceso, se reduce la esperanza de vida de la hembra. En algunos casos, esta reacción inmunológica puede ser tan masiva como para ser fatal casi de inmediato. Una hembra de Hesperocimex sonorensis se hinchará, se ennegrecerá y morirá dentro de las 24 a 48 horas posteriores a la inseminación traumática de un macho de H. cochimiensis.[1]
Prácticas de apareamiento similares[editar]
En el reino animal, la inseminación traumática no es única como forma de sexo coercitivo. La investigación sugiere que en el género de escarabajos de agua Acilius no existe un sistema de cortejo entre machos y hembras. “Es un sistema de violación. Pero las hembras no se toman las cosas con calma. Evolucionan contra-armas". Los comportamientos de apareamiento citados incluyen machos que asfixian a las hembras bajo el agua hasta que se agotan, y permiten solo el acceso ocasional a la superficie para respirar durante un máximo de seis horas (para evitar que se reproduzcan con otros machos), y hembras que tienen una variedad de formas corporales (para dificultar que los machos consigan un agarre). Los juegos previos están "limitados a que la hembra intente desesperadamente desalojar al macho nadando frenéticamente".[34]
Se ha observado "comportamiento de violación" en varias especies de patos. En la cerceta de alas azules, "los intentos de violación por parte de machos emparejados pueden ocurrir en cualquier momento durante la temporada de reproducción". Las razones citadas para que esto sea beneficioso para los machos emparejados incluyen la reproducción exitosa y ahuyentar a los intrusos de su territorio.[35] Las manadas de machos juveniles solteros de delfines nariz de botella a veces se unen a una hembra y la obligan a tener relaciones sexuales con ellos, nadando cerca de ella, persiguiéndola si intenta escapar y profiriendo amenazas verbales o físicas.[36][37] En el mundo de los insectos, los machos de los zancudos acuáticos, incapaces de penetrar su escudo genital, atraerán a los depredadores hacia una hembra hasta que copule.[38]
Véase también[editar]
Referencias[editar]
- ↑ a b c d e f g h i j k l m n Arnqvist, Göran; Rowe, Locke (5 de julio de 2005). Sexual Conflict (Monographs in Behavior and Ecology). Princeton, NJ: Princeton University Press. pp. 87-91. ISBN 978-0-691-12218-2.
- ↑ a b Reinhardt, K.; Naylor R.; Siva-Jothy, M. T. (22 de noviembre de 2003). «Reducing a cost of traumatic insemination: female bedbugs evolve a unique organ». Proceedings of the Royal Society B 270 (1531): 2371-2375. PMC 1691512. PMID 14667353. doi:10.1098/rspb.2003.2515.
- ↑ a b c Carayon, J. (1966). «Paragenital system». Monograph of Cimicidae (Hemiptera, Heteroptera). College Park, MD: Entomological Society of America. pp. 81-166. ISBN 978-0-9776209-2-0.
- ↑ Ruck, B.N. «Circulatory System». Saint Michael's College. Archivado desde el original el 19 de junio de 2009. Consultado el 19 de agosto de 2009.
- ↑ Arnqvist, citing A.D. Stutt, Reproductive Strategies and Sexual Conflict in the Bed Bug. PhD thesis. University of Sheffield, England.
- ↑ Arnqvist 89, citing personal observations and Monograph of Cimicidae
- ↑ Smith, Jane A. (1991). «A Question of Pain in Invertebrates». ILAR Journal 33 (1–2): 25-31. doi:10.1093/ilar.33.1-2.25. Archivado desde el original el 18 de abril de 2009. Consultado el 7 de abril de 2009. «En la mayoría de los ejemplos de nocicepción de invertebrados mencionados anteriormente, parece haber poca o ninguna evidencia de que las respuestas de los animales persistan de forma similar a la descrita para los mamíferos. Como Eisemann et al. (1984) han descrito en una revisión de la 'evidencia biológica' sobre el dolor en los insectos: 'No conocemos ningún ejemplo de un insecto que muestre un comportamiento protector hacia las partes lesionadas, como cojear después de una lesión en la pierna o negarse a alimentarse o aparearse porque de lesiones abdominales generales. Por el contrario, nuestra experiencia ha sido que los insectos continuarán con sus actividades normales incluso después de una lesión grave o la extirpación de partes del cuerpo.'... Ciertamente, en la cantidad limitada de evidencia presentada aquí, parece muy difícil imaginar que los insectos y el otros invertebrados más simples mencionados anteriormente pueden 'sufrir' dolor en un sentido similar al de los vertebrados. Sin embargo, el tema ciertamente no está cerrado, y se deben hacer más preguntas.»
- ↑ a b Stutt AD, Siva-Jothy MT (8 de mayo de 2001). «Traumatic insemination and sexual conflict in the bed bug Cimex lectularius». Proceedings of the National Academy of Sciences 98 (10): 5683-87. Bibcode:2001PNAS...98.5683S. PMC 33273. PMID 11331783. doi:10.1073/pnas.101440698.
- ↑ a b Quammen, David (16 de febrero de 1998). The Flight of the Iguana: A Sidelong View of Science and Nature. Simon & Schuster. pp. 29–30. ISBN 978-0-684-83626-3.
- ↑ Trowbridge, C. D. (1995). «Hypodermic insemination, oviposition, and embryonic development of a pool-dwelling ascoglossan (=sacoglossan) opisthobranch: Ercolania felina (Hutton, 1882) on New Zealand shores». The Veliger 38: 203-211.
- ↑ Waldbauer, Gilbert (11 de febrero de 1998). Insects through the seasons. Harvard University Press. p. 63. ISBN 978-0-674-45489-7.
- ↑ Tatarnic, Nikolai J; Gerasimos Cassis; Dieter F Hochuli (22 de marzo de 2006). «Traumatic insemination in the plant bug genus Coridromius Signoret (Heteroptera: Miridae)». Biology Letters 2 (1): 58-61. PMC 1617170. PMID 17148326. doi:10.1098/rsbl.2005.0394.
- ↑ Reinhardt, Klaus; Naylor, Richard A.; Siva-Jothy, Michael T. (21 de septiembre de 2005). «Potential sexual transmission of environmental microbes in a traumatically inseminating insect». Ecological Entomology 30 (5): 607-611. doi:10.1111/j.0307-6946.2005.00730.x.
- ↑ Arnqvist, citing Monograph of Cimicidae
- ↑ «Research Projects: Physiological mechanisms of sexual conflict». University of Sheffield Department of Animal & Plant Sciences. Archivado desde el original el 5 de mayo de 2006. Consultado el 19 de septiembre de 2004.
- ↑ Morrow, Edward H.; Arnqvist, Göran (22 de noviembre de 2003). «Costly traumatic insemination and a female counter-adaptation in bed bugs». Proceedings of the Royal Society B 270 (1531): 2377-2381. PMC 1691516. PMID 14667354. doi:10.1098/rspb.2003.2514.
- ↑ a b c Siva-Jothy MT (28 de febrero de 2006). «Trauma, disease and collateral damage: conflict in cimicids». Philosophical Transactions of the Royal Society B 361 (1466): 269-75. PMC 1569606. PMID 16612886. doi:10.1098/rstb.2005.1789.
- ↑ Siva-Jothy MT, Alistair DS (March 2003). «A matter of taste: direct detection of female mating status in the bedbug». Proceedings of the Royal Society B 270 (1515): 649-652. PMC 1691276. PMID 12769466. doi:10.1098/rspb.2002.2260.
- ↑ Anderson, Roy Clayton (2000). Nematode parasites of vertebrates. CABI. p. 233. ISBN 978-0-85199-421-5.
- ↑ Hugot, JP (19 de abril de 1982). «Traumatic insemination and tubular egg receptacle in the pinworm [Passalurus ambigus] parasite of the common domestic rabbit». Comptes Rendus de l'Académie des Sciences, Série III 294 (14): 707-10.
- ↑ Doyle, Lester R.; Larry N. Gleason (June 1991). «Suckers and Other Bursal Structures of Pomphorhynchus bulbocolli and Acanthocephalus dirus (Acanthocephala)». The Journal of Parasitology 77 (3): 437-40. PMID 2040955. doi:10.2307/3283132.
- ↑ Wallace, R. L. (1998). «Rotifera». En Knobil, Ernst; Neill, Jimmy D, eds. Encyclopedia of Reproduction. Boston: Academic Press. pp. 290–301. ISBN 978-0-12-227020-8.
- ↑ Obst, Matthias; Funch, Peter (6 de enero de 2003). «Dwarf male of symbion pandora (cycliophora)». Journal of Morphology 255 (3): 261-78. PMID 12520546. doi:10.1002/jmor.10040.
- ↑ Michiels, N. K.; Newman, L. J. (12 de febrero de 1998). «Sex and violence in hermaphrodites». Nature 391 (6668): 647-8. Bibcode:1998Natur.391..647M. ISSN 0028-0836. doi:10.1038/35527.
- ↑ Milius, S. «Hermaphrodites duel for manhood». Science News Online. Archivado desde el original el 26 de marzo de 2008. Consultado el 19 de agosto de 2009.
- ↑ Viegas, Jennifer (30 de junio de 2015). «Hermaphrodite Worm Has Sex With Its Head». Discovery Communications. Archivado desde el original el 27 de abril de 2016. Consultado el 2 de julio de 2015.
- ↑ Beani L, Giusti F, Mercati D, Lupetti P, Paccagnini E, Turillazzi S, Dallai R (26 de julio de 2005). «Mating of Xenos vesparum (Rossi) (Strepsiptera, Insecta) revisited». Journal of Morphology 265 (3): 291-303. PMID 16047336. doi:10.1002/jmor.10359.
- ↑ Kamimura, Yoshitaka (22 de agosto de 2007). «Twin intromittent organs of Drosophila for traumatic insemination». Biology Letters 3 (4): 401-404. PMC 2391172. PMID 17519186. doi:10.1098/rsbl.2007.0192.
- ↑ Schmitt V, Anthes N, Michiels NK (2007). «Mating behaviour in the sea slug Elysia timida (Opisthobranchia, Sacoglossa): hypodermic injection, sperm transfer and balanced reciprocity». Frontiers in Zoology 4: 17. PMC 1934903. PMID 17610714. doi:10.1186/1742-9994-4-17.
- ↑ Řezáč, Milan (29 de abril de 2009). «The spider Harpactea sadistica: co-evolution of traumatic insemination and complex female genital morphology in spiders». Proceedings of the Royal Society B 276 (1668): 2697-701. PMC 2839943. PMID 19403531. doi:10.1098/rspb.2009.0104. Abstract at link
- ↑ Reinhardt, Klaus; Ewan Harney; Richard Naylor; Stanislav Gorb; Michael T. Siva‐Jothy (2007). «Female‐Limited Polymorphism in the Copulatory Organ of a Traumatically Inseminating Insect». American Naturalist 170 (6): 931-35. PMID 18171174. doi:10.1086/522844.
- ↑ Krebs, John R.; Davies, Nicholas B. (1993). An Introduction to Behavioural Ecology. Wiley-Blackwell. p. 186. ISBN 978-0-632-03546-5., citing Carayon, J. (1974). «Insemination traumatique heterosexuelle et homosexuelle chez Xylocoris maculipennis (Hem., Anthocoridae)». Comptes Rendus de l'Académie des Sciences 278: 2803-06.
- ↑ Abele, Lawrence G.; Sandra Gilchrist (1977). «Homosexual Rape and Sexual Selection In Acanthocephalan Worms». Science 197 (4298): 81-83. Bibcode:1977Sci...197...81A. PMID 867055. doi:10.1126/science.867055.
- ↑ Smith, Lewis (25 de junio de 2007). «Not tonight, not ever. I've got a headache. Don't come near me». The Times (London). p. 25. Consultado el 3 de abril de 2009.
- ↑ Bailey, Robert O.; Seymour, Norman R.; Stewart, Gary R. (January 1978). «Rape Behavior in Blue-Winged Teal». The Auk 95 (1): 188-90. doi:10.2307/4085514.
- ↑ Angier, Natalie (18 de febrero de 1992). «Dolphin Courtship: Brutal, Cunning and Complex». The New York Times (New York City). p. C1. Consultado el 3 de abril de 2009.
- ↑ Connor, Richard C.; F. Andrew; Rachel A. Smolker; Janet Mann (February 1996). «Patterns of Female Attractiveness in Indian Ocean Bottlenose Dolphins». Behaviour 133 (1/2): 37-69. doi:10.1163/156853996X00026.
- ↑ Han, Chang S.; Jablonski, Piotr G. (August 2010). «Male water striders attract predators to intimidate females into copulation». Nature Communications 1 (52): 52. Bibcode:2010NatCo...1...52H. PMC 2964456. PMID 20975717. doi:10.1038/ncomms1051.
