Pila de combustible de membrana de intercambio protónico

Las pilas de combustible de membrana de intercambio protónico (PEMFC), también conocidas como pilas de combustible de membrana electrolítica polimérica (PEM), son un tipo de pila de combustible que se está desarrollando principalmente para aplicaciones de transporte, así como para aplicaciones estacionarias de pilas de combustible y aplicaciones portátiles de pilas de combustible. Se caracterizan por tener rangos de temperatura/presión más bajos (de 50 a 100 °C) y una membrana electrolítica polimérica especial conductora de protones. Las PEMFC generan electricidad y funcionan según el principio opuesto al de la electrólisis PEM, que consume electricidad. Son uno de los principales candidatos a sustituir a la anticuada tecnología de pilas de combustible alcalinas, que se utilizó en el transbordador espacial.[1]
Ciencia[editar]
Las pilas PEMFC se construyen a partir de conjuntos de electrodos de membrana (MEA) que incluyen los electrodos, el electrolito, el catalizador y las capas de difusión de gases. Una tinta de catalizador, carbono y electrodo se pulveriza o pinta sobre el electrolito sólido y el papel de carbono se prensa en caliente a ambos lados para proteger el interior de la célula y actuar también como electrodos. La parte fundamental de la célula es el triple límite de fase (TPB), donde se mezclan el electrolito, el catalizador y los reactivos y, por tanto, donde se producen realmente las reacciones de la célula.[2] Es importante que la membrana no sea conductora de la electricidad para que las medias reacciones no se mezclen. Se desean temperaturas de funcionamiento superiores a 100 °C para que el subproducto agua se convierta en vapor y la gestión del agua sea menos crítica en el diseño de la célula.
Reacciones[editar]
Una celda de combustible de membrana de intercambio de protones transforma la energía química liberada durante la reacción electroquímica del hidrógeno y el oxígeno en energía eléctrica, a diferencia de la combustión directa de los gases de hidrógeno y oxígeno para producir energía térmica.
Se entrega una corriente de hidrógeno al lado del ánodo del MEA. En el lado del ánodo se divide catalíticamente en protones y electrones . Esta reacción de oxidación de media celda o reacción de oxidación de hidrógeno (HOR) está representada por:
En el ánodo:
Los protones recién formados penetran a través de la membrana electrolítica de polímero hacia el lado del cátodo. Los electrones viajan a lo largo de un circuito de carga externo al lado del cátodo del MEA, creando así la salida de corriente de la celda de combustible. Mientras tanto, se envía una corriente de oxígeno al lado del cátodo del MEA. En el lado del cátodo, las moléculas de oxígeno reaccionan con los protones que atraviesan la membrana electrolítica de polímero y los electrones que llegan a través del circuito externo para formar moléculas de agua. Esta reacción de semicelda de reducción o reacción de reducción de oxígeno (ORR) está representada por:
En el cátodo:
| [3] |
Reacción general:
La reacción reversible se expresa en la ecuación y muestra la reincorporación de los protones y electrones de hidrógeno junto con la molécula de oxígeno y la formación de una molécula de agua. Los potenciales en cada caso se dan con respecto al electrodo de hidrógeno estándar .
Membrana electrolítica de polímero[editar]

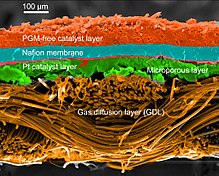

Para funcionar, la membrana debe conducir iones de hidrógeno (protones) pero no electrones, ya que esto provocaría un "cortocircuito" en la pila de combustible. La membrana tampoco debe permitir que ninguno de los gases pase al otro lado de la pila, un problema conocido como cruce de gases.[5][6] Por último, la membrana debe ser resistente al entorno reductor del cátodo y al entorno oxidativo del ánodo.
El desdoblamiento de la molécula de hidrógeno es relativamente fácil si se utiliza un catalizador de platino. Sin embargo, la separación de la molécula de oxígeno es más difícil, lo que provoca importantes pérdidas eléctricas. Aún no se ha descubierto un material catalizador adecuado para este proceso, y el platino es la mejor opción.
mbustible.[7]
Aplicaciones[editar]
La principal aplicación de las pilas de combustible PEM se centra en el transporte, sobre todo por su posible impacto en el medio ambiente, por ejemplo el control de la emisión de gases de efecto invernadero (GEI). Otras aplicaciones son la generación de energía distribuida/estacionaria y portátil. La mayoría de las grandes empresas automovilísticas trabajan exclusivamente con pilas de combustible PEM debido a su alta densidad de potencia y excelentes características dinámicas en comparación con otros tipos de pilas de combustible.[8] Debido a su poco peso, las pilas PEMFC son las más adecuadas para aplicaciones de transporte. Las pilas PEMFC para autobuses, que utilizan hidrógeno comprimido como combustible, pueden funcionar con un rendimiento de hasta el 40%. Por lo general, las PEMFC se implantan en autobuses en lugar de en coches más pequeños debido al volumen disponible para albergar el sistema y almacenar el combustible. Las cuestiones técnicas para el transporte implican la incorporación de las PEM a la tecnología actual de los vehículos y la actualización de los sistemas energéticos. Los vehículos de pila de combustible completa no son ventajosos si el hidrógeno procede de combustibles fósiles; sin embargo, resultan beneficiosos cuando se implementan como híbridos. Las pilas PEMFC tienen potencial para la generación de energía estacionaria, ya que proporcionan 5 kW con un rendimiento del 30%; sin embargo, compiten con otros tipos de pilas de combustible, principalmente las SOFC y las MCFC. Mientras que las PEMFC suelen necesitar hidrógeno de alta pureza para funcionar, otros tipos de pilas de combustible pueden funcionar con metano y son, por tanto, sistemas más flexibles. Por lo tanto, las PEMFC son mejores para sistemas a pequeña escala hasta que se disponga de hidrógeno puro económicamente escalable. Además, las PEMFC tienen la posibilidad de sustituir a las pilas de los aparatos electrónicos portátiles, aunque la integración del suministro de hidrógeno es un reto técnico, sobre todo si no se dispone de un lugar adecuado para almacenarlo dentro del dispositivo.
Historia[editar]
Antes de la invención de las pilas de combustible PEM, los tipos de pilas de combustible existentes, como las de óxido sólido, sólo se aplicaban en condiciones extremas. Además, estas pilas de combustible requerían materiales muy caros y, debido a su tamaño, sólo podían utilizarse en aplicaciones estacionarias. Estos problemas se resolvieron con la pila de combustible PEM. La pila de combustible PEM fue inventada a principios de los años 60 por Willard Thomas Grubb y Leonard Niedrach, de General Electric.[9] Al principio se utilizaban membranas de poliestireno sulfonado para los electrolitos, pero en 1966 se sustituyeron por ionómero de Nafion, que demostró ser superior en rendimiento y durabilidad al poliestireno sulfonado.
Las celdas de combustible PEM se utilizaron en la serie de naves espaciales Gemini de la NASA, pero fueron reemplazadas por celdas de combustible alcalinas en el programa Apolo y en el transbordador espacial. General Electric continuó trabajando en celdas PEM y, a mediados de la década de 1970, desarrolló la tecnología de electrólisis de agua PEM para el soporte de la vida submarina, lo que condujo a la planta generadora de oxígeno de la Marina de los EE. UU. La Royal Navy británica adoptó esta tecnología a principios de la década de 1980 para su flota de submarinos. A fines de la década de 1980 y principios de la de 1990, el Laboratorio Nacional de Los Álamos y la Universidad de Texas A&M experimentaron con formas de reducir la cantidad de platino necesaria para las células PEM.[10]
Paralelamente a Pratt and Whitney Aircraft, General Electric desarrolló las primeras celdas de combustible de membrana de intercambio de protones (PEMFC) para las misiones espaciales Gemini a principios de la década de 1960. La primera misión en utilizar PEMFC fue Gemini V. Sin embargo, las misiones espaciales Apollo y las posteriores misiones Apollo-Soyuz, Skylab y Space Shuttle utilizaron celdas de combustible basadas en el diseño de Bacon, desarrollado por Pratt and Whitney Aircraft.
Se utilizaban materiales muy caros y las pilas de combustible requerían hidrógeno y oxígeno muy puros. Las primeras pilas de combustible tendían a requerir temperaturas de funcionamiento inconvenientemente elevadas que suponían un problema en muchas aplicaciones. Sin embargo, las pilas de combustible se consideraron convenientes por la gran cantidad de combustible disponible (hidrógeno y oxígeno). A pesar de su éxito en los programas espaciales, los sistemas de pilas de combustible se limitaban a misiones espaciales y otras aplicaciones especiales, en las que podía tolerarse un coste elevado. No fue hasta finales de los 80 y principios de los 90 cuando las pilas de combustible se convirtieron en una opción real para una base de aplicaciones más amplia. Varias innovaciones fundamentales, como la baja carga de catalizador de platino y los electrodos de película fina, abarataron el coste de las pilas de combustible, haciendo más realista el desarrollo de los sistemas PEMFC.[11] Sin embargo, existe un gran debate sobre si las pilas de combustible de hidrógeno serán una tecnología realista para su uso en automóviles u otros vehículos (véase economía del hidrógeno).Gran parte de la producción de PEMFC se destina al Toyota Mirai. El Departamento de Energía de EE.UU. estima un precio en 2016 de 53 $/kW si se fabricaran 500.000 unidades al año.
Véase también[editar]
Referencias[editar]
- ↑ Loyselle, Patricia; Prokopius, Kevin (August 2011). «Teledyne Energy Systems, Inc., Proton Exchange Member (PEM) Fuel Cell Engineering Model Powerplant. Test Report: Initial Benchmark Tests in the Original Orientation». NASA (Glenn Research Center). hdl:2060/20110014968.
- ↑ Millington, Ben; Du, Shangfeng; Pollet, Bruno G. (2011). «The Effect of Materials on Proton Exchange Membrane Fuel Cell Electrode Performance». Journal of Power Sources 196 (21): 9013-017. Bibcode:2011JPS...196.9013M. doi:10.1016/j.jpowsour.2010.12.043.
- ↑ Bratsch, Stephen G. (1989). «Standard Electrode Potentials and Temperature Coefficients in Water at 298.15 K». J. Phys. Chem. Ref. Data 18 (1): 1-21. Bibcode:1989JPCRD..18....1B. doi:10.1063/1.555839.
- ↑ a b Yin, Xi; Lin, Ling; Chung, Hoon T; Komini Babu, Siddharth; Martinez, Ulises; Purdy, Geraldine M; Zelenay, Piotr (4 de agosto de 2017). «Effects of MEA Fabrication and Ionomer Composition on Fuel Cell Performance of PGM-Free ORR Catalyst». ECS Transactions 77 (11): 1273-1281. Bibcode:2017ECSTr..77k1273Y. doi:10.1149/07711.1273ecst.
- ↑ Schalenbach, Maximilian; Hoefner, Tobias; Paciok, Paul; Carmo, Marcelo; Lueke, Wiebke; Stolten, Detlef (28 de octubre de 2015). «Gas Permeation through Nafion. Part 1: Measurements». The Journal of Physical Chemistry C 119 (45): 25145-25155. doi:10.1021/acs.jpcc.5b04155.
- ↑ Schalenbach, Maximilian; Hoeh, Michael A.; Gostick, Jeff T.; Lueke, Wiebke; Stolten, Detlef (14 de octubre de 2015). «Gas Permeation through Nafion. Part 2: Resistor Network Model». The Journal of Physical Chemistry C 119 (45): 25156-25169. doi:10.1021/acs.jpcc.5b04157.
- ↑ Daud, W. R. W.; Rosli, R. E.; Majlan, E. H.; Hamid, S. A. A.; Mohamed, R.; Husaini, T. (1 de diciembre de 2017). «PEM fuel cell system control: A review». Renewable Energy (en inglés) 113: 620-638. ISSN 0960-1481. doi:10.1016/j.renene.2017.06.027.
- ↑ [1] Y. Wang, Ken S. Chen, Jeffrey Mishler, Sung Chan Cho, Xavier Cordobes Adroher, A Review of Polymer Electrolyte Membrane Fuel Cells: Technology, Applications, and Needs on Fundamental Research, Applied Energy 88 (2011) 981-1007.
- ↑ PEM Fuel Cells. Americanhistory.si.edu. Retrieved on 2013-04-19.
- ↑ «Collecting the History of Proton Exchange Membrane Fuel Cells». americanhistory.si.edu. Consultado el 7 de enero de 2022.
- ↑ Eberle, Ulrich; Mueller, Bernd; von Helmolt, Rittmar (15 de julio de 2012). «Fuel cell electric vehicles and hydrogen infrastructure: status 2012». Royal Society of Chemistry. Consultado el 8 de enero de 2013.
Enlaces externos[editar]
- Capa de difusión de gas y capa de catalizador, animación 3D
- Iwan, L. y Stengel, R., " La aplicación de las redes neuronales a los procesadores de combustible para celdas de combustible " en IEEE Transactions on Vehicular Technology, vol. 50 (1), págs. 125-143, 2001.
- Elementos de celdas de combustible, animación 3D
- Herramienta de simulación de pila de combustible PEM de código abierto








