Reacción de Koenigs-Knorr
La reacción de Koenigs–Knorr es una reacción en química orgánica que consiste en una sustitución nucleófila entre un alcohol y un 1-halomonosacárido poliacetilado para obtener el 1-alcoximonosacárido correspondiente. Esta reacción se puede utilizar para glucosilar compuestos que contengan un hidroxilo disponible. Fue nombrada en honor de los químicos Wilhelm Koenigs (1851–1906), y Edward Knorr, estudiante de Koenigs.

La reacción reportada por Koenigs y Knorr consistía en el tratamiento de 1-bromopentacetilglucosa con alcoholes en presencia de carbonato de plata[1] Poco después, Fischer y Armstrong reportaron resultados muy similares.[2]
En el ejemplo anterior, la estereoquímica del producto se determina por la asistencia anquimérica que ofrece el grupo vecino del carbono 2. El resultado es la formación de una configuración 1,2-trans. Los grupos acilo (por ejemplo acetilo, pivalilo, benzoilo) generalmente proveen ayuda anquimérica significativa, mientras que los grupos alquilo (por ejemplo bencilo, metilo, etilo, etc.) no presentan este fenómeno, lo que lleva a las mezclas de estereoisómeros.
Generalmente, en la reacción de Koenigs–Knorr se utilizan cloruros y bromuros y recientemente, bromuros.
La reacción de Koenigs–Knorr puede ser llevada a cabo con sales de diversos metales, tales como bromuro de mercurio (II) en óxido de mercurio (II), cianuro de mercurio y triflato de plata.[3][4]
Método de Helferich[editar]
Una variante de la reacción de Koenigs–Knorr es el método de Helferich, en donde se conecta un monosacárido poliacetilado a un fenol en presencia de un haluro de metal (ZnCl2, FeCl3). Se puede utilizar ácido p-toluenosulfónico como catalizador:[5]

Mecanismo[editar]
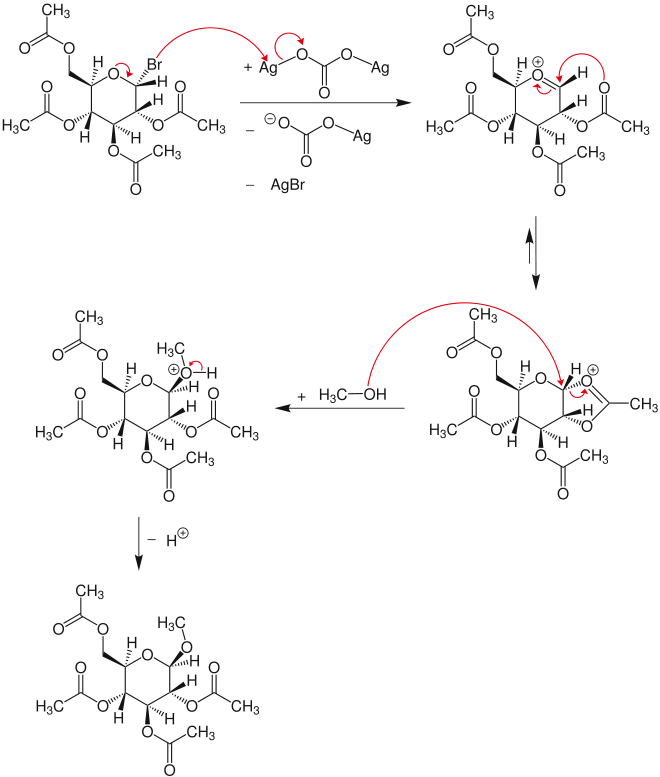
En el primer paso del mecanismo, el bromuro de glicosilo reacciona con carbonato de plata tras la eliminación de bromuro de plata y el anión de carbonato de plata al ion oxocarbenio. A partir de esta estructura se forma un dioxolaniumnium, que es atacado por metanol a través de un mecanismo SN 2 en el átomo de carbono carbonilo. Este ataque lleva a la inversión. Después de la escisión de un átomo de hidrógeno, se forma el glucósido.[6]
La reacción también se puede aplicar a los carbohidratos con otros grupos protectores. En la síntesis de oligosacáridos en lugar del metanol se utilizan otros carbohidratos, que se han modificado con grupos protectores de tal manera que solo se puede acceder a un grupo hidroxilo.
Referencias[editar]
- ↑ Wilhelm Koenigs and Edward Knorr (1901). «Ueber einige Derivate des Traubenzuckers und der Galactose (p )». Berichte der deutschen chemischen Gesellschaft 34 (1): 957-981. doi:10.1002/cber.190103401162.
- ↑ Hermann Emil Fischer, Armstrong, E.F. (1901). «Ueber die isomeren Acetohalogen-Derivate des Traubenzuckers und die Synthese der Glucoside». Berichte der deutschen chemischen Gesellschaft 34 (2): 2885-2900. doi:10.1002/cber.190103402251.Fischer, E. and Armstrong, E.F. (1901) Ber. Dtsch. Chem. Ges., 34, 2885
- ↑ Helferich, B. and Zirner, J. (1962) Chem. Ber., 95, 2604
- ↑ Hanessian, S. and Banoub, J. (1980) Methods Carbohydr. Chem., 8, 247
- ↑ B. Helferich, E. Schmitz-Hillebrecht, Ber. 66, 378 (1933)
- ↑ László Kürti und Barbara Czakó.: Strategic Applications of Named Reactions in Organic Synthesis: Background and Detailed Mechanisms, Elsevier Academic Press, 2005, page 246-247, ISBN 978-0-12-429785-2.