Síntesis de aminoácidos de Erlenmeyer-Plöchl
La síntesis de aminoácidos de Erlenmeyer-Plöchl fue descubierta por primera vez en 1893 por el químico alemán Friedrich Gustav Carl Emil Erlenmeyer que condensó el benzaldehído con N-acetilglicina en presencia de anhídrido acético y acetato de sodio (incluso hay casos en los que se pueden usar cantidades catalíticas de base (del 10% mol), pero en vez de acetato de sodio, se emplea fosfato de potasio). La reacción va vía condensación de Perkin seguida de la ciclación de la N-acetilglicina produciendo las llamadas azlactonas de Ernelmeyer. Estas azlactonas de Erlenmeyer son realmente oxazolonas.[1][2]
Por la síntesis de Erlenmeyer de azlactonas se pueden sintetizar a partir de la reacción de un aldehído aromático con un ácido carboxílico aromático (como por ejemplo el ácido hipúrico) en presencia de anhídrido acético.

Mecanismo de la síntesis[editar]
El mecanismo ya se ha comentado que se trata de dos reacciones acopladas: Reacción de Perkin + ciclación del ácido aromático correspondiente[3]

Hasta aquí se describe la obtención de la azlactona u oxazolona.
Preparación de α-cetoácidos[editar]
A partir de la oxazolona puede producirse por hidrólisis los α-cetoácidos correspondientes:

Preparación de α-aminoácidos[editar]
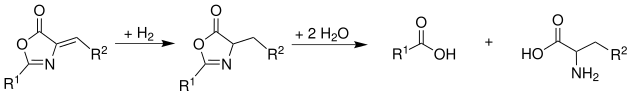
Si antes de la hidrólisis se hace una reducción con H2 (hidrógeno) se obtienen los correspondientes aminoácidos:
Síntesis de fenilalanina[editar]
Como puede observarse en la siguiente figura, el ácido hipúrico[4] se autocondensa en presencia del anhídrido acético para formar la 2-fenil-oxazolona.[5] Este intermedio también tiene dos protones ácidos y reacciona con benzaldehído, anhídrido acético y acetato de sodio para formar una azlactona u oxazolona. Este compuesto al reducirlo da la fenilalanina.[6]

Extensión de la síntesis[editar]
En un estudio se utilizó la síntesis de aminoácidos de Erlenmeyer para la síntesis del aminoácido tirosina[7]
Referencias[editar]
- ↑ Plöchl J. (1884). «Über einige Derivate der Benzoylimdozimtsäure». Chemische Berichte 17: 1623.
- ↑ Erlenmeyer, F. (1893). «Ueber die Condensation der Hippursäure mit Phtalsäureanhydrid und mit Benzaldehyd». Ann. 275: 3. doi:10.1002/jlac.18932750102.
- ↑ Z. Wang (2009). Comprehensive Organic Name Reactions and Reagents. Wiley Verlag. ISBN 978-0-471-70450-8.
- ↑ A. W. Ingersoll, S. H. Babcock (1943). «Hippuric acid». OrgSynth 2: 328.
- ↑ G. E. VandenBerg, J. B. Harrison, H. E. Carter, B. J. Magerlein (1973). «2-Phenyl-2-oxazolone». OrgSynth 5: 946.
- ↑ H. B. Gillespie, H. R. Snyder (1943). «dl-β-Phenylalanine». OrgSynth 2: 489.
- ↑ Cara E. Humphrey, Markus Furegati, Kurt Laumen, Luigi La Vecchia, Thomas Leutert, J. Constanze D. Müller-Hartwieg, and Markus Vögtle (2007,). «Optimized Synthesis of L-m-Tyrosine Suitable for Chemical Scale-Up». Organic Process Research & Development 11: 1069-1075. doi:10.1021/op700093y.

