Tiofeno
| Tiofeno | |
|---|---|
| |
| Nombre IUPAC | Tiofeno |
| Otros nombres | Tiofurano, Tiaciclopentadieno |
| Fórmula empírica | C4H4S |
| Masa molecular | 84,14 g/mol |
| Estado físico/Color | Líquido/Incoloro |
| Número CAS | 110-02-1 |
| Propiedades | |
| Densidad | 1,051 g/cm³ a 20 °C |
| Punto de fusión | -38,0 °C (187,6 K) |
| Punto de ebullición | 84,0 °C (304,4 K) |
| Solubilidad en agua | 0 g/l a 25 °C |
| Información de Seguridad | |
| Exenciones y Referencias[1][2][3] | |
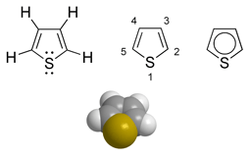
El tiofeno es un compuesto heterocíclico con fórmula C4H4S. Es un anillo plano de cinco miembros, aromático. Relacionados al tiofeno están el benzotiofeno y el dibenzotiofeno, que contienen el anillo de tiofeno unido a uno o dos anillos de benceno respectivamente. Además, compuestos análogos al tiofeno son también el furano y pirrol.
Aislamiento y presencia en la naturaleza[editar]
El tiofeno fue descubierto como un contaminante en el benceno.[4] Se observó que la isatina forma una tinta azul cuando es mezclada con el ácido sulfúrico y benceno crudo. La formación del azul indofenina se adjudicó durante mucho tiempo a una reacción con el benceno. Victor Meyer, luego fue capaz de aislar la sustancia responsable de esta reacción desde el benceno. Este nuevo compuesto heterocíclico fue el tiofeno.[5]
El tiofeno y sus derivados se encuentran en el petróleo, a veces en concentraciones de 1-3%. El tiofeno contenido en el petróleo y en el carbón es extraído mediante el proceso de hidrodesulfuración (HDS). En la HDS, el líquido o el gas pasa sobre un catalizador de disulfuro de molibdeno bajo presión de H2.
Los tiofenos experimentan además hidrógenolisis para formar hidrocarburos y sulfuro de hidrógeno. De esta forma, el tiofeno se convierte en butano y H2S. Aunque en el petróleo se encuentra mayor cantidad de benzotiofeno y dibenzotiofeno.
Diversas plantas sintetizan tiofenos con actividad nematicida, como es el caso del α-tertienilo producido por asteráceas del género Tagetes.
Síntesis y producción[editar]
Como un reflejo de sus estabilidades, los tiofenos se forman desde muchas reacciones que involucran fuentes de azufre e hidrocarburos, especialmente aquellos insaturados por ejemplo: acetilenos y azufre elemental. La cual fue la primera síntesis de tiofeno realizada por Viktor Meyer en el año de su descubrimiento. Más regularmente los tiofenos son preparados por la reacción entre 1,4-dicetonas, diésteres o dicarboxilatos con reactivos sulfurantes como P4S10. Tiofenos más específicos pueden ser sintetizados utilizando el reactivo de Lawesson como agente sulfurante o mediante la Reacción de Gewald, que involucra la condensación de dos ésteres en presencia de azufre elemental. Otro método es la Ciclación de Volhard-Erdmann.
El tiofeno es producido en una escala de aproximadamente de dos millones de kilos por año mundialmente. La producción involucra una reacción en fase gaseosa entre una fuente de azufre, normalmente disulfuro de carbono y n-butanol. Estos reactivos se ponen en contacto con un catalizador de óxido a 500-550 °C.[6]
Propiedades[editar]
A temperatura ambiente, el tiofeno es un líquido incoloro con un débil olor agradable que recuerda al del benceno con el cual el tiofeno posee algunas similitudes. La alta reactividad del benceno hacia la sulfonación constituye la base para la separación del tiofeno del benceno. Separación que resulta complicada para realizar mediante destilación debido a sus puntos de ebullición similares (4 °C de diferencia a presión ambiente). Como el benceno, el tiofeno forma un azeótropo con el etanol.
La molécula, es plana; el ángulo de enlace en el azufre es de unos 93°, el ángulo C-C-S es de alrededor de 109° y los otros dos carbonos poseen un ángulo de enlace de 114°. Las longitudes de los enlaces C-C adyacentes al azufre son de 1.34A, la longitud del C-S es de 1.07A y el otro C-C es de 1.41A.
Reactividad[editar]
El tiofeno es considerado aromático, aunque los cálculos teóricos sugieren que el grado de aromaticidad es menor que aquel del benceno. Los pares electrónicos del azufre están significativamente deslocalizados en el sistema π. Como una consecuencia de su aromaticidad, el tiofeno no exhibe las propiedades típicas de los tioéteres. Por ejemplo, el átomo de azufre, resiste la alquilación y la oxidación.
Frente a electrófilos[editar]
Aunque el átomo de azufre es muy poco reactivo, los carbonos adyacentes (carbonos 2 y 5), son altamente susceptibles al ataque de electrófilos. Los halógenos dan inicialmente 2-halo derivados seguidamente dando, 2,5-dihalotiofenos; la perhalogenación es fácilmente alcanzable dando C4X4S (X = Cl, Br, I).[7] El Tiofeno se broma 107 veces más rápido que el benceno.[6]
La clorometilación y la cloroetilación ocurre fácilmente en las posiciones 2 y 5. La reducción del producto clorometilo da 2-metiltiofeno. La hidrólisis seguida de deshidratación de los productos cloroetílicos da 2-viniltiofeno.[8][9]
Desulfuración con níquel Raney[editar]
La desulfuración del tiofeno con Níquel Raney proporciona butano. Cuando se acopla a la 2,5-difuncionalización del tiofeno, la desulfuración constituye una vía para obtener butanos 1,4-disustituidos.
Litiación[editar]
No solamente frente a electrófilos es reactivo el tiofeno, también es fácilmente litiado con n-butil-litio para dar 2-litiotiofeno, el cual es un precursor para muchos otros derivados como el ditienil.[10]
Química de coordinación[editar]
El tiofeno exhibe un comportamiento similar al del tioéter, pero sirve como un ligando pi formando complejos tipo taburete de piano como Cr(η5-C4H4S)(CO)3.[11]
Politiofeno[editar]
El polímero formado por la unión entre tiofenos a través de las posiciones 2,5 es llamado politiofeno. El politiofeno en sí mismo posee pobres propiedades de procesamiento. Más útiles son los polímeros derivados de los tiofenos sustituidos en las posiciones 3- y 4-. Los politiofenos se tornan conductores eléctricos luego de una oxidación parcial (se convierten en 'metales orgánicos')[12]
Usos[editar]
Los tiofenos son importantes compuestos heterocíclicos que son usados ampliamente como ingredientes en muchos agroquímicos y drogas.[6] El anillo de benceno de un compuesto biológicamente activo puede ser muchas veces reemplazado por un tiofeno sin pérdida de actividad.[13] Esto se observa, por ejemplo, en las drogas antiinflamatorias no esteroideas (NSAID) como el lornoxicam, el análogo de tiofeno del piroxicam.
Véase también[editar]
Compuestos similares estructuralmente o químicamente:
- Análogos del tiofeno
- Alcalinidad, resonancia y acidez del Tiofeno
Referencias[editar]
- ↑ «Fichas internacionales de seguridad química (FISQ)». Archivado desde el original el 18 de diciembre de 2008. Consultado el 12 de marzo de 2011.
- ↑ Fichas de datos de seguridad (FDS)
- ↑ Hazardous Substances Data Bank (HSDB)
- ↑ Viktor Meyer (1883). «Ueber den Begleiter des Benzols im Steinkohlenteer». Berichte der Deutschen chemischen Gesellschaft 16: 1465-1478. doi:10.1002/cber.188301601324.
- ↑ Ward C. Sumpter (1944). «The Chemistry of Isatin». Chemical Reviews. 34, (3): 393-434. doi:10.1021/cr60109a003.
- ↑ a b c Jonathan Swanston “Thiophene” in Ullmann’s Encyclopedia of Industrial Chemistry Wiley-VCH, Weinheim, 2006. doi 793.pub2 10.1002/14356007.a26 793.pub2.
- ↑ Henry Y. Lew and C. R. Noller (1963). "2-Iodolthiophene". Org. Synth.; Coll. Vol. 4: 545.
- ↑ W. S. Emerson and T. M. Patrick, Jr. (1963). "2-Vinylthiophene". Org. Synth.; Coll. Vol. 4: 980.
- ↑ K. B. Wiberg and H. F. McShane (1955). "2-Chloromethylthiophene". Org. Synth.; Coll. Vol. 3: 1.
- ↑ E. Jones and I. M. Moodie (1988). "2-Thiophenethiol". Org. Synth.; Coll. Vol. 6: 979.
- ↑ Rauchfuss, T. B., "The Coordination Chemistry of Thiophenes", Progress in Inorganic Chemistry 1991, volume 39, pp. 259-311. ISBN 978-0-471-54489-0
- ↑ J. Roncali (1992). «Conjugated poly(thiophenes): synthesis, functionalization, and applications». Chem. Rev. 92 (4): 711-738. doi:10.1021/cr00012a009.
- ↑ Daniel Lednicer (1999). The Organic Chemistry of Drug Synthesis 6. New York: Wiley Interscience. p. 187. ISBN 0-471-24510-0.
