Tivozanib
| Tivozanib | ||
|---|---|---|
 | ||
| Identificadores | ||
| Número CAS | 475108-18-0 | |
| Datos químicos | ||
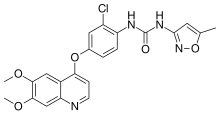
| Fórmula | C22H19N4ClO5 | |
|
O=C(Nc1noc(c1)C)Nc4ccc(Oc2c3cc(OC)c(OC)cc3ncc2)cc4Cl
| ||
|
InChI=InChI=1S/C22H19ClN4O5/c1-12-8-21(27-32-12)26-22(28)25-16-5-4-13(9-15(16)23)31-18-6-7-24-17-11-20(30-3)19(29-2)10-14(17)18/h4-11H,1-3H3,(H2,25,26,27,28)
Key: SPMVMDHWKHCIDT-UHFFFAOYSA-N | ||
| Farmacocinética | ||
| Unión proteica | 99% | |
| Vida media | 4.5–5.1 días | |
| Excreción | 79% heces, 12% orina | |
| Datos clínicos | ||
| Uso en lactancia | Restricción total del uso del fármaco. (en todos los países) | |
| Cat. embarazo | X (AU) X. Restricción total del uso del fármaco. Los riesgos superan los beneficios potenciales (EUA) | |
| Estado legal | S6 (AU) ℞-only (EUA) [1] | |
| Vías de adm. | Vía oral | |
Tivozanib, vendido bajo la marca Fotivda, es un medicamento utilizado para tratar el carcinoma de células renales.[1] Específicamente se utiliza para enfermedades avanzadas en las que otros tratamientos no han dado resultado. [1] Se toma por vía oral.[1]
Los efectos secundarios de este medicamento incluyen cansancio, presión arterial alta, diarrea, náuseas, cambios en la voz, tiroides baja, tos e inflamación de la boca; [1] otros efectos secundarios pueden incluir niveles bajos de sodio, problemas cardíacos, coágulos sanguíneos, sangrado y aumento de la lipasa . [1] El uso de este medicamento durante el embarazo puede dañar al bebé. [1] Es un inhibidor de la tirosina quinasa del receptor VEGF, que bloquea la formación de nuevos vasos sanguíneos . [2] [1]
Este medicamento fue aprobado para uso médico en Europa en 2017 y en Estados Unidos en 2021. [2] [1] En Estados Unidos, 4 semanas de tratamiento cuestan unos 26.000 dólares. [3]
Referencias[editar]
- ↑ a b c d e f g h i «Fotivda- tivozanib capsule». DailyMed. Archivado desde el original el 13 de septiembre de 2021. Consultado el 12 de septiembre de 2021.
- ↑ a b «Fotivda EPAR». European Medicines Agency (EMA). Archivado desde el original el 13 de mayo de 2021. Consultado el 16 de marzo de 2021.
- ↑ «Tivozanib». Archivado desde el original el 31 de ctubre de 2022. Consultado el 31 de ctubre de 2022.
Enlaces externos[editar]
- Esta obra contiene una traducción derivada de «User:Mr. Ibrahem/Tivozanib» de Wikipedia en inglés, concretamente de esta versión del 04 de diciembre de 2023, publicada por sus editores bajo la Licencia de documentación libre de GNU y la Licencia Creative Commons Atribución-CompartirIgual 4.0 Internacional.
 Portal:Medicina. Contenido relacionado con Medicina.
Portal:Medicina. Contenido relacionado con Medicina.
