Tricoteceno
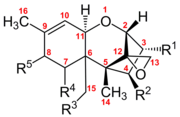
Los tricotecenos son una familia de micotoxinas producidas por varias especies de hongos de los géneros Fusarium, Myrothecium, Trichoderma, Trichothecium, Cephalosporium, Verticimonosporium, y Stachybotrys.
Los tricotecenos son sesquiterpenos con un peso molecular entre 250 y 550 dalton; reciben su nombre por poseer el esqueleto tetracíclico,12,13-epoxitricotec-9-eno.[1] Pueden contar con grupos hidroxilos o acetilos en ciertas posiciones en núcleo de la molécula y cadenas laterales de estructura variada. Se dividen en cuatro grupos, A, B, C y D según su estructura y la especie productora.
Los tricotecenos del grupo A y B son producidos por especies del género Fusarium, por ejemplo, F. graminearum, F. sporotrichioides, F. poae y F. equiseti y son contaminantes naturales de los cereales. Los tricotecenos del grupo D son generalmente producidos por mohos en el interior de edificios, por ejemplo, Stachybotrys chartarum. El tipo C es el menos frecuente.[2][3] Todos ellos son potentes inhibidores de la síntesis de proteínas[4] y pueden ser utilizados como armas biológicas.[3]
Clases de tricotecenos[editar]
Los tricotecenos son sesquiterpenos caracterizados químicamente por un doble enlace entre los carbonos 9 y 10 y un grupo epóxido entre los carbonos 12 y 13, que confiere a la molécula una gran estabilidad frente a nucleófilos. Conservan su actividad bajo muy diferentes condiciones ambientales, incluyendo temperaturas de hasta 120 °C. Presentan diferencias en su grupo funcional, lo cual permite dividirlos en cuatro clases:
- Clase A: Esta clase se caracteriza por un grupo funcional no acetónico en el carbono 8. Esta clase es la más numerosa y entre sus miembros se incluyen las toxinas T-2 y HT-2 y el diacetoxiscirpenol (DAS). Estas toxinas son producidas frecuentemente por hongos de las especies F. tricinactun, F. sporotrichioides, F. poe y F. equiseti, hallados en cereales, gramíneas y suelos en zonas templadas y templadas-frías.[1][3]
- Clase B: Caracterizada por un grupo carbonilo en el carbono 8, esta clase incluye los tricotecenos 4-deoxivalenol (DON) y nivalenol, ambos producidos por F.graminearum y F. culmorum, el primero de distribución mundial y el segundo más frecuente en zonas templadas. Como los hongos productores de las toxinas de la clase A, se encuentran principalmente en cereales y gramíneas.[1][3]
- Clase C: Esta clase cuenta con un segundo grupo epóxido en los carbonos 7 y 8, o 9 y 10. Son producidos por pocas especies.[3]
- Clase D: Contienen un anillo macrocíclico entre los carbonos 4 y 15 con dos enlaces estéricos. Entre ellos, cabe destacar la satratoxina, producida por el género Stachybotrys. Myrothecium también produce tricotecenos pertenecientes a esta clase.[3]
Biosíntesis[editar]
La biosíntesis de tricotecenos está condicionada por circunstancias tanto genéticas como ambientales. Se han estudiado varios genes en las especies productoras involucrados en la biosíntesis de estos compuestos. Se ha descubierto que la glucosa es necesaria y la presencia del aminoácido leucina estimula la producción de tricotecenos.
Entre las condiciones ambientales, se ha estudiado la influencia de la actividad acuosa (aw), cuyo valor óptimo se encuentra por encima de 0,92; la producción disminuye rápidamente para valores de aw menores que 0,75. En cuanto a la temperatura, los tricotecenos aparecen entre los 1,5 y los 28 °C; las caídas bruscas de temperatura estimulan la producción.[5]
Toxicidad[editar]
Los tricotecenos son tóxicos para humanos, animales y plantas, debido a su capacidad de inhibición de la síntesis de proteínas en las células eucarióticas. Este efecto inhibidor es la consecuencia de la reacción de la molécula con los ribosomas, los orgánulos celulares donde se forman las proteínas. Los tejidos donde las células se encuentran en la fase de división o crecimiento o con importante actividad metabólica son particularmente susceptibles a esta toxina. Entre ellos se encuentran el epitelio del sistema digestivo, la médula ósea, nódulos linfáticos, el bazo y el hígado.[6] Los animales recién nacidos son más sensibles que los adultos.[3]
La dosis letal media o DL50 varía mucho entre los distintos tricotecenos; en el ratón es de 0,5 mg/kg para la verrucarina, 5,2 mg/kg para la toxina T-2, 9,0 mg/kg para el diacetilnivalenol, 23,0 mg/kg para el DAS y 70,0mg/kg para el DON. La crotocina, con una DL50 de 810,0 mg/kg, es uno de los tricotocenos menos tóxicos. La vía de administración también influye en la toxicidad; por ejemplo, la dL50 de la toxina T-2 es una 50 veces mayor cuando se administra por ingestión que cuando se inhala.[3]
Efectos para la salud[editar]
Los efectos inmediatos de estas toxinas incluyen la irritación de la piel, ojos y garganta y vómitos. Entre los efectos a más largo plazo se encuentran la leucopenia tóxica alimentaria, caracterizada por puntos en la piel, angina necrótica, leucopenia, hemorragias internas y agotamiento de la médula ósea; también son comunes los desórdenes gastrointestinales.[7][4] La concentración máxima en los tejidos se alcanza a las tres horas y la toxina se elimina completamente del organismo en unas 72 horas.[5]
Los tricotecenos se encuentran en todo el mundo, aunque la distribución de las diferentes toxinas varía. Históricamente, los brotes de intoxicación más importantes se han producido en zonas de gran producción de cereales. Se calcula que unas 100 000 personas fallecieron en la Unión Soviética debido a la aleukia tóxica, enfermedad causada por el consumo de granos infestados por Fusarium.[8] Una enfermedad equina de similar etiología, akakabibyo, se ha asociado con granos contaminados por tricotecenos en Japón[9] También se atribuye a cereales y sus derivados contaminados por DON, toxina T-2 y NIV algunos brotes de desórdenes gastrointestinales en China[10] También se ha descrito la intoxicación por tricotecenos por inhalación o contacto en edificios contaminados por hongos del género Stachybotrys.[11]
Uso como arma biológica[editar]
Los tricotecenos pueden ser sintetizados fácilmente en grandes cantidades y dispersados como gotas, aerosol o polvo, por lo cual se pueden utilizar como arma biológica. Se diferencian de otras sustancias con potencial como armas biológicas en que se pueden absorber por la piel. Al contrario que otras micotoxinas como la aflatoxina los tricotecenos no precisan de una activación metabólica y causan efectos rápidamente tras contacto directo, inhalación o ingestión. Existen sospechas de que la toxina T-2 ha sido utilizada con este fin en Camboya, Laos y Afghanistán entre 1974 y 1981, causando miles de muertes.[12][13] Otras fuentes, sin embargo, disputan estas alegaciones.[14][15]
Se puede prevenir la intoxicación usando ropas protectivas especiales y máscaras. En caso de exposición, se recomienda quitar la ropa al paciente, lavar la piel con mucho jabón y enjuagarla con agua abundante. La toxina se puede desactivar sumergiendo las ropas u objetos contaminados en una solución de hidróxido de sodio al 5% durante unas 4 a 6 horas. El carbón activado secuestra las micotoxinas y se puede administrar por vía oral en caso de ingestión o inhalación.[13][3]
Regulación[editar]
En algunos países, principalmente en la Unión Europea, se recomiendan unos niveles máximos de estas micotoxinas en los alimentos para el consumo humano y del ganado.
En América del Sur, la Comisión del Codex Alimentarius elaboró un documento (CAC/RCP 51-2003) para reducir la contaminación de los cereales por micotoxinas. Este documento sirve de guía para desarrollar mecanismos de prevención específicos para cada país.[16]
Véase también[editar]
Referencias[editar]
- ↑ a b c Soriano del Castillo, José Miguel (2007). Micotoxinas en alimentos. Ediciones Díaz de Santos. ISBN 9788479788087.
- ↑ Etzel, R.A. (2002). «Mycotoxins». Journal of the American Medical Association 287 (4): 425-427. PMID 11798344. doi:10.1001/jama.287.4.425.
- ↑ a b c d e f g h i Domínguez Carmona, Manuel (2005). «Las toxinas como agresivos químicos: micotoxinas» (PDF). Monografías de la Real Academia Nacional de Farmacia: 121-187. Archivado desde el original el 20 de julio de 2015. Consultado el 24 de enero de 2012.
- ↑ a b Food-Info. «Tricotecenos». Universidad de Wageningen, Países Bajos.
- ↑ a b Hernández, Enrique. «Tricotecenos: Diagnóstico, Patología e Influencia sobre la Producción». Archivado desde el original el 17 de septiembre de 2011. Consultado el 5 de febrero de 2012.
- ↑ «T-2 Toxin, Essential Data» (en inglés). Archivado desde el original el 4 de febrero de 2012. Consultado el 27 de enero de 2012.
- ↑ Soriano del Castillo, José Miguel (2007). Micotoxinas en alimentos. Ediciones Díaz de Santos. p. 12. ISBN 9788479788087.
- ↑ Joffe, A. Z. (1950.). «Toxicity of fungi on cereals overwintered in the field: on the etiology of alimentary toxic aleukia.». Inst. Bot. Acad. Sci. Leningrad.: 205.
- ↑ Ueno, Y.; Ishii, K.; Sakai, K.; Kanaeda, S.; Tsunoda, H. (1972). «Toxicological approaches to the metabolites of Fusaria. IV. Microbial survey on “bean-hulls poisoning of horses” with the isolation of toxic trichothecenes, neosolaniol and T-2 toxin of Fusarium solani M-1-1». Japanese J. Exp. Med. 42: 187-203.
- ↑ Lou, X.Y. (1988). «Fusarium toxins contamination of cereals in China». Proc. Japanese Assoc. Mycotoxicology; Suplemento 1: 97-98.
- ↑ Martí Solé, María del Carmen; Alonso Espadalé, María Rosa; Constans Aubert, Angelina. «NTP: 351: Micotoxinas (aflatoxinas y tricotecenos) en ambientes laborales» (PDF). Fichas técnicas del Instituto Nacional de Seguridad e Higiene en el Trabajo. Archivado desde el original el 4 de octubre de 2010. Consultado el 5 de febrero de 2011.
- ↑ U.S. Congress, Office of Technology Assessment (1993). «Technical Aspects of Biological Weapon Proliferation» (PDF). Technologies Underlying Weapons of Mass Destruction (en inglés). Archivado desde el original el 20 de julio de 2015. Consultado el 31 de enero de 2012.
- ↑ a b Park, Chan W. «T-2 Mycotoxins» (en inglés). Consultado el 31 de enero de 2012.
- ↑ Christopher, G.W.; Cieslak, T.J.; Pavlin, J.A.; Eitzen, E.M. (1997). «Biological warfare. A historical perspective». JAMA 278 (5): 412-417. PMID 9244333. doi:10.1001/jama.278.5.412.
- ↑ Frischknecht, F. (2003). «The history of biological warfare. Human experimentation, modern nightmares and lone madmen in the twentieth century». EMBO Rep. (en inglés) 4: S47-S52. PMC 1326439. PMID 12789407. doi:10.1038/sj.embor.embor849.
- ↑ «Nuevas consideraciones para los cereales en América latina». Alimentación.org.ar. Consultado el 5 de febrero de 2012.
Enlaces externos[editar]
 Wikimedia Commons alberga una categoría multimedia sobre tricotecenos.
Wikimedia Commons alberga una categoría multimedia sobre tricotecenos.- Avitaminosis, Marek y tricotecenos en avicultura
- Micotoxicosis del ganado
- Fusariosis de la espiga en trigo y cebada
