Nitrona

Una nitrona es el N-óxido de una imina y es un grupo funcional en química orgánica. La estructura general es R1R2C=NR3+O-, donde R3 es diferente a H.
Síntesis[editar]
Las nitronas se pueden preparar por la reacción de cetonas o dienos (alquenos que contienen dos enlaces dobles), con hidroxilaminas alquiladas. Inicialmente se produce un ataque nucleofílico del átomo de nitrógeno al carbono del carbonilo, creando un compuesto intermedio con el nitrógeno cargado positivamente y el oxígeno cargado negativamente en el antiguo carbonilo. Después de la eliminación de agua se obtiene mediante la formación de un doble enlace entre el nitrógeno y el carbono, la estructura nitrona. Una posibilidad adicional es la deshidrogenación de una hidroxiamina sustituida con grupos alquilo. La N-alquilación de oximas y la deshidrogenación oxidativa de aminas secundarias conduce a las nitronas también.[1] Aquí se esquematizan las diversas vías:

Reactividad[editar]
Una nitrona es un 1,3-dipolo en la reacción de cicloadición 1,3-dipolar. Reacciona con alquenos para formar isoxazolidinas.
Un ejemplo de este tipo de reacción es la reacción de varios aductos de Baylis-Hillman con C-fenil-N-metilnitrona, formando una isoxazolidina en la que R1 es fenilo, R2 es hidrógeno y R3 es un grupo metilo.[2]
Las nitronas reaccionan con alquinos terminales y una sal de cobre para formar β-lactamas. Esta reacción también es llamada la reacción Kinugasa[3] por ejemplo en esta reacción:[4]
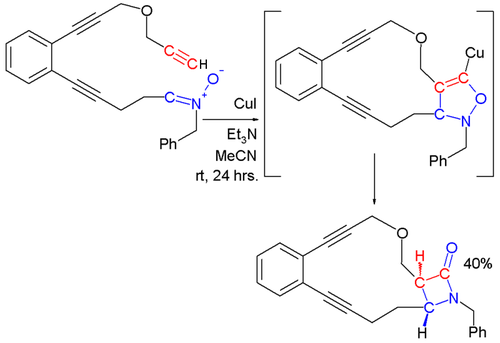
El primer paso en esta reacción es una cicloadición dipolar de la nitrona con el acetiluro de cobre(I) generado in situ para formar una estructura de anillo de 5-miembros, que se rearregla en el segundo paso.
Las nitronas también reaccionan como electrofilos cuando se enfrentan a nucleofilos (mediante reacciones de adición nucleófila). Es necesario activar la nitrona generalmente con un ácido de lewis, aunque en muchas ocasiones el propio nucleofilo (especialmente si es un compuestos organometalico) es capaz de llevar a cabo dicha activación mediante la coordinación del átomo metálico al oxígeno de la nitrona.
Referencias[editar]
- ↑ D. Döpp, H. Döpp In: D. Klamann (Hrsg.): Methoden der Organischen Chemie. Bd. E14b, Thieme Verlag, Stuttgart 1990, ISBN 3-13-220004-2, S. 1372-1544.
- ↑ Diastereoselectivity of Nitrone 1,3-Dipolar Cycloaddition to Baylis-Hillman Adducts Branislav Dugovič, Lubor Fišera, Christian Hametner and Nada Prónayovác. Arkivoc 2004 BS-834A Artículo
- ↑ The reactions of copper(I) phenylacetylide with nitrones Manabu Kinugasa and Shizunobu Hashimoto J. Chem. Soc., Chem. Commun., 1972, 466 - 467, doi 10.1039/C39720000466
- ↑ A novel synthesis of -lactam fused cyclic enediynes by intramolecular Kinugasa reaction Runa Pal and Amit Basak Chem. Commun., 2006, 2992 - 2994, doi 10.1039/b605743h

