Trioxidano
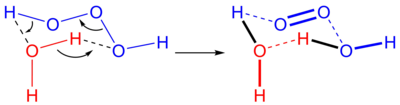
Trióxido de dihidrógeno, trióxido de hidrógeno o trioxidano es una molécula inestable con fórmula química H2O3 o HOOOH. Es uno de los polióxidos de hidrógeno. En disolución acuosa el trioxidano se descompone en agua y oxígeno singlete:
La reacción inversa no ocurre debido a la escasez de oxígeno singlete. Sin embargo, en algunos sistemas biológicos se puede generar ozono a partir de óxigeno singlete. Se cree que esto se debe a una reacción catalizada por anticuerpos.[1]
Obtención[editar]
El trioxidano se puede obtener en cantidades pequeñas pero detectables mediante una reacción entre el ozono y el peróxido de hidrógeno o por electrólisis del agua. Se han podido obtener cantidades más grandes haciendo reaccionar el ozono con agentes reductores orgánicos a temperaturas bajas y en una variedad de disolventes orgánicos, como en el proceso de la antraquinona. También es posible la obtención por descomposición de hidroxotrióxidos orgánicos (ROOOH).[2]
La reacción entre el peróxido de hidrógeno y el ozono se conoce como el "proceso de la peroxona". Esta mezcla ha sido usada algún tiempo en la remediación de la contaminación con compuestos orgánicos de aguas subterráneas. La reacción produce H2O3 y H2O5.[3]
Estructura[editar]
El análisis espectroscópico ha mostrado que la molécula tiene una estructura asimétrica H-O-O-O-H, con una longitud de enlace O-O algo inferior que el enlace O-O en el peróxido de hidrógeno. Parece que existen varias formas diméricas y triméricas del compuesto. Tiene un carácter algo más ácido que el peróxido de hidrógeno, disociando en H+ y OOOH-.[4]
Reacciones[editar]
El trioxidano descompone fácilmente en agua y oxígeno singlete con una semivida de 16 minutos en disolventes orgánicos a temperatura ambiente pero apenas de milisegundos en agua. Reacciona con sulfuros orgánicos para dar sulfoóxidos, pero poco más se conoce de su reactividad. Estudios recientes han hallado que el trioxidano es el agente activo responsable del efecto antimicrobiano de las mezclas de peróxido de hidrógeno y ozono. Como estos dos compuestos están presentes en el cuerpo humano se discute si los anticuerpos pueden generar trioxidano como un potente agente oxidante contra las bacterias invasoras.[1][5] La fuente del compuesto en los sistemas biológicos es la reacción entre el oxígeno singlete y el agua(la reacción puede transcurrir en ambos sentidos, por supuesto, dependiendo de las concentraciones) con el oxígeno singlete producido por los anticuerpos.[2][6] En 2005 se pudo observar experimentalmente mediante espectroscopía de microondas en un vehículo supersónico. La molécula estaba en una conformación trans con una longitud de enlace O-O de 142,8 picómetros en comparación con los 146,4 picómetros en el peróxido de hidrógeno. La química computacional predice que pueden existir más cadenas moleculares de oxígeno o polióxidos de hidrógeno e incluso de infinitas en fase gaseosa a temperaturas muy bajas. Con estos datos espectroscópicos puede comenzar la búsqueda de estos compuestos en el espacio exterior.[4]
Referencias[editar]
- ↑ a b Paul T. Nyffeler, Nicholas A. Boyle, Laxman Eltepu, Chi-Huey Wong, Albert Eschenmoser, Richard A. Lerner, Paul Wentworth Jr. (2004). «Dihydrogen Trioxide (HOOOH) Is Generated during the Thermal Reaction between Hydrogen Peroxide and Ozone». Angewandte Chemie International Edition 43 (35): 4656-4659. PMID 15317003. doi:10.1002/anie.200460457.
- ↑ a b Božo Plesničar (2005). «Progress in the Chemistry of Dihydrogen Trioxide (HOOOH)» (PDF). Acta Chim. Slov 52: 1-12. Consultado el 23 de abril de 2012.
- ↑ Xin Xu and William A. Goddard III. Peroxonechemistry:Formation of H2O3 and ring-(HO2)(HO3) from O3/H2O2
- ↑ a b Kohsuke Suma, Yoshihiro Sumiyoshi, and Yasuki Endo (2005). «The Rotational Spectrum and Structure of HOOOH». J. Am. Chem. Soc. 127 (43): 14998-14999. PMID 16248618. doi:10.1021/ja0556530. Archivado desde el original el 23 de mayo de 2013. Consultado el 20 de mayo de 2018.
- ↑ A Time-Honored Chemical Reaction Generates an Unexpected Product, News & Views, September 13, 2004
- ↑ Roald Hoffmann (2004). «The Story of O». American Scientist. doi:10.1511/2004.1.23. Archivado desde el original el 3 de marzo de 2016. Consultado el 6 de enero de 2014.