Triyoduro de nitrógeno
| Triyoduro de nitrógeno | ||
|---|---|---|
 Fórmula estructural | ||
 Estructura tridimensional. | ||
| General | ||
| Otros nombres | Yoduro de nitrógeno, Triyoduro de amoníaco | |
| Fórmula estructural |
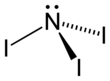 | |
| Fórmula molecular | NI3 | |
| Identificadores | ||
| Número CAS | 13444-85-4[1] | |
| ChemSpider | 55511 | |
| PubChem | 61603 | |
| Propiedades físicas | ||
| Apariencia | rojo (parecido al ladrillo) | |
| Masa molar | 39 477 g/mol | |
| Propiedades químicas | ||
| Solubilidad en agua | no | |
| Peligrosidad | ||
| NFPA 704 |
0
1
4
| |
| Riesgos | ||
| Riesgos principales | Explosivo extremadamente sensible | |
| Valores en el SI y en condiciones estándar (25 ℃ y 1 atm), salvo que se indique lo contrario. | ||
El triyoduro de nitrógeno o triioduro de nitrógeno es un compuesto inorgánico con la fórmula NI3. Se trata de un explosivo extremadamente sensible; pequeñas cantidades explotan cuando son tocadas ligeramente (incluso usando una pluma), liberando una nube irritante púrpura de vapor de yodo, incluso puede ser detonado por la radiación alfa. El NI3 posee una compleja química estructural que es difícil de estudiar debido a la inestabilidad de los derivados. Su punto de fusión empieza a los -20 °C y este empieza a sublimar.
Estructura del NI3 y sus derivados[editar]
El triyoduro de nitrógeno fue caracterizado por primera vez mediante cristalografía de rayos X en 1990 cuando este fue preparado sin utilizar amoníaco. El nitruro de boro reacciona con monofluoruro de yodo en triclorofluorometano a -30 °C para producir NI3 puro con un rendimiento bajo:
- BN + 3IF → NI3 + BF3
El NI3 es piramidal (C3v simetría molecular), como son los otros trihaluros de nitrógeno y amoníaco.[2]
El material generalmente denominado "triyoduro de nitrógeno" se prepara mediante la reacción de yodo con amoníaco. Cuando esta reacción se lleva a cabo a bajas temperaturas en amoníaco anhidro; el producto inicial es NI3 · (NH3)5, pero este material pierde un poco de amoníaco con el calentamiento para dar el aducto 1:1 NI3 · (NH3). Este aducto fue descrito por primera vez por Bernard Courtois en 1812, y su fórmula se determinó finalmente en 1905 por Oswald Silberrad.[3] Esta estructura de estado sólido consiste en cadenas de -NI2-I-NI2-I-NI2-I-... Moléculas de amoniaco se encuentran entre las cadenas. En la oscuridad, manteniéndose frío y humedecido con amoníaco, NI3 · (NH3) es más estable. Cuando el NI3 está seco se convierte en un explosivo altamente sensible y muy inestable que puede ser detonado incluso usando una pluma, esto se debe a que la estabilización obtenida por el aducto con el NH3 es muy baja y una perturbación energética baja puede romper esta estabilidad, dando paso a la descomposición instantánea a NH3, I2 y N2 todos en estado gaseoso. Se puede observar que pasa de un estado sólido a tres gases, lo cual muestra el por qué la reacción libera tanta energía en tan poco tiempo con una energía de activación muy baja.
Descomposición[editar]
La descomposición del NI3 se produce mediante la siguiente reacción:
- 2 NI3(s) → N2(g) + 3 I2(g) ΔH = –290 kJ/mol
Véase también[editar]
Enlaces externos[editar]
Referencias[editar]
- ↑ Número CAS
- ↑ Holleman, A. F.; Wiberg, E. (2001). Academic Press, ed. Inorganic Chemistry. San Diego. ISBN 0-12-352651-5.
- ↑ Silberrad, O. (1905). «The Constitution of Nitrogen Triiodide». Journal of the Chemical Society, Transactions 87: 55-66. doi:10.1039/CT9058700055.

