Wolframato
4)
Las sales de ácido wolfrámico se denominan wolframatos, volframatos o tungstatos. Están relacionados químicamente con cromatos y molibdatos.
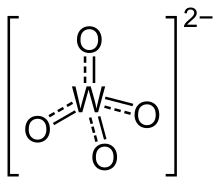
Los wolframatos se conocen en las diversas proporciones entre ácidos y bases, siendo la forma más simple el ortowolframato WO2−
4.[1] En el pasado, las sales se clasificaban según la proporción, por lo que las sales del ácido parawolframatico también se llamaban parawolframatos y las del ácido perwolframatico se llamaban perwolframatos, aunque también existían por nombre otras formas como el ácido isowolframatico o el ácido metawolframatico.
Además del parawolframato de sodio Na10W12O41 + 28 H2O y el wolframato de potasio K2WO4, que sirven como retardadores de fuego para madera y sustancias altamente inflamables, también como agente decapante en teñido, muchas sales se utilizan como pinturas, como el wolframato de níquel NiWO4 (verde), wolframato de cromo (verde), wolframato de cobalto (violeta), wolframato de estaño (azul índigo), wolframato de bario BaWO4 (blanco de tungsteno) y wolframato de hierro FeWO4 (gamuza). Además, el wolframato de amonio (NH4)10W12O41, el wolframato de litio Li2WO4 y el wolframato de sodio Na2WO4 sirven como catalizadores en síntesis orgánicas. El wolframato de magnesio MgWO4 y especialmente el wolframato de plomo PbWO4 se utilizan como centelleadores modernos en la física de partículas.
Por supuesto, los wolframatos se dan en forma de mineral como la scheelita (tungstato de calcio CaWO4), wolframita (cristal mixto), ferberita (tungstato de hierro), hubnerita (tungstato de manganeso), sanmartinita (cristal mixto de hierro-zinc-tungstato), estolzita (plomo tungstato), kraselnoselita (tungstato de cobre) y algunos otros.
Referencias[editar]
- ↑ Egon Wiberg, Arnold Frederick Holleman (2001). Inorganic Chemistry. Elsevier. ISBN 0-12-352651-5.
